Angelikasav
| angelikasav | |||
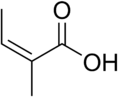 Az angelikasav kémiai szerkezete | |||
 Az angelikasav pálcikamodellje | |||
| Más nevek | (Z)-2-metilbut-2-énsav, cisz-2-metilkrotonsav | ||
| Kémiai azonosítók | |||
|---|---|---|---|
| CAS-szám | 565-63-9 | ||
| PubChem | 643915 | ||
| ChemSpider | 559009 | ||
| ChEBI | 36431 | ||
| |||
| InChIKey | UIERETOOQGIECD-ARJAWSKDSA-N | ||
| ChEMBL | 55941 | ||
| Kémiai és fizikai tulajdonságok | |||
| Kémiai képlet | C5H8O2 | ||
| Moláris tömeg | 100,12 g/mol | ||
| Olvadáspont | 45,5 °C | ||
| Forráspont | 185 °C | ||
| Ha másként nem jelöljük, az adatok az anyag standardállapotára (100 kPa) és 25 °C-os hőmérsékletre vonatkoznak. | |||
Az angelikasav telítetlen monokarbonsav. Leginkább a zellerfélék (Apiaceae) családjába tartozó növényekben fordul elő. Ludwig Andreas Buchner német gyógyszerész izolálta 1842-ben az orvosi angyalgyökér (Angelica archangelica) gyökeréből, ami a vegyület névadója is lett. Csípős ízű és szúrós, savanyú szagú, illékony szilárd vegyület. A 2-metil-2-buténsav cisz izomere, melegítés vagy szervetlen savak hatására könnyen átalakul tiglinsavvá, a transz izomerré. A visszaalakulás jóval nehezebben megy végbe. Sói és észterei az angelátok.
Neve és felfedezése
szerkesztésElsőként Ludwig Andreas Buchner (1813–1897) német gyógyszerész izolálta 1842-ben az orvosi angyalgyökér (Angelica archangelica) gyökeréből. A vegyületet a növény után nevezte el.[1]
Előfordulása
szerkesztésSzámos, elsősorban a zellerfélék családjába tartozó növény gyökerében megtalálható, például Angelica archangelica, Peucedanum ostruthium (mestergyökér), Levisticum officinale (orvosi lestyán),[2][3] Euryangium sumbul és Laserpitium latifolium. A sárgarépa olajában is megtalálható.[4] Kinyerhető a kamillafélék virágának olajából is, a római kamilla (Anthemis nobilis) olajának 85%-át az angelikasav és tiglinsav észterei alkotják,[5][6] ezen kívül izobutil-angelát és amil-angelát is található benne.[7] A legnagyobb savtartalma az Angelica archangelica-nak van,[8] mintegy 0,3%.[2]
Tulajdonságai
szerkesztésCsípős ízű és szúrós, savanyú szagú, illékony szilárd anyag. Színtelen monoklin prizmák formájában kristályosodik, melyek alkoholban[9] vagy forró vízben jól, hideg vízben lassan oldódnak. Az angelikasav és tiglinsav a 2-metil-2-buténsav are cisz és transz izomerjei. Előbbi teljesen átalakítható a másik izomerré kb. 40 órán keresztül történő forralással, kénsavval vagy más savval történő reakcióval,[8] bázis jelenlétében 100 °C hőmérséklet fölé történő hevítéssel.[4] Az átalakulás kb. 25 évig történő tárolás során is végbemegy.[10] A másik irányú átalakulás jóval nehezebben megy végbe, ultraibolya fény válthatja ki (a látható fény energiája nem elegendő). Az átalakulás sebessége kicsi, mindössze 0,36 g angelikasav nyerhető 13 g tiglinsavból 43 nap, 500 wattos lámpával történő besugárzás hatására. Az angelikasavnak, mint cisz izomernek, alacsonyabb az olvadáspontja és nagyobb a savi disszociációs állandója, mint a tiglinsavnak,[11] ez összhangban van a szokásos trendekkel.[12][13]
Hidrogén-bromiddal és brómmal reagálva rendre brómvaleriánsav, illetve dibrómvaleriánsav keletkezik, 60–70%-os hozammal. Klórvaleriánsav és jódvaleriánsav hidrogén-kloriddal, illetve hidrogén-jodiddal történő reakcióval állítható elő. Sóit angelátoknak nevezzük. Az M alkáliföldfémek angelátjai fehér, vízoldható kristályokat alkotnak, általános képletük M(C5H7O2)2.[8]
Hivatkozások
szerkesztés- ↑ Buchner, L. A. (1842). „Ueber eine eigenthümliche flüchtige Säure aus der Angelicawurzel: Eine briefliche Mittheilung”. Justus Liebigs Ann. Chem. 42, 226–233. o. DOI:10.1002/jlac.18420420211.
- ↑ a b Rudolf Fritz Weiss Weiss's herbal medicine, Thieme, 2001, ISBN 1-58890-069-X pp. 46, 91, 236
- ↑ K. V. Peter Handbook of herbs and spices, Volume 2, Woodhead Publishing, 2004, ISBN 1-85573-721-3 p. 96
- ↑ a b (1981) „Isolation and identification of a new conjugated carbofuran metabolite in carrots: angelic acid ester of 3-hydroxycarbofuran”. Journal of Agricultural and Food Chemistry 29 (6), 1125–9. o. DOI:10.1021/jf00108a006. PMID 7320331.
- ↑ Ernest Small Culinary herbs, National Research Council Canada, 2006, ISBN 0-660-19073-7 p. 288
- ↑ Lyle E. Craker, James E. Simon Herbs, Spices, and Medicinal Plants: Recent Advances in Botany, Horticulture, and Pharmacology, Routledge, 1986, ISBN 1-56022-043-0 p. 257
- ↑ Henry Watts, Henry Forster Morley, Matthew Moncrieff Pattison Muir Watts' Dictionary of Chemistry, Volume 1, Longmans, Green, 1888, p. 266
- ↑ a b c William Allen Miller, Herbert McLeod Elements of Chemistry, Vol. 3: Chemical physics, p. 958
- ↑ Friedrich Wöhler Wöhler's Outlines of organic chemistry, p. 124
- ↑ Year-book of pharmacy, p. 92
- ↑ (1952) „The Ultraviolet-induced Isomerization of Tiglic Acid to Angelic Acid”. Journal of the American Chemical Society 74, 6292. o. DOI:10.1021/ja01144a518.
- ↑ Vickie Vaclavik, Vickie A. Vaclavik, Elizabeth W. Christian Essentials of food science, Springer, 2007, ISBN 0-387-69939-2, p. 282
- ↑ D. Nasipuri Stereochemistry of Organic Compounds: Principles and Applications, New Age International, 1994, ISBN 81-224-0570-3, p. 192
Fordítás
szerkesztésEz a szócikk részben vagy egészben az Angelic acid című angol Wikipédia-szócikk ezen változatának fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.