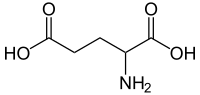
Glutaminsav
| glutaminsav | |||
| |||
 glutaminsav | |||
| IUPAC-név | glutaminsav | ||
| Szabályos név | 2-aminopentándisav | ||
| Más nevek | 2-aminoglutársav | ||
| Kémiai azonosítók | |||
|---|---|---|---|
| CAS-szám | 617-65-2 | ||
| ChemSpider | 591 | ||
| KEGG | D0434 | ||
| ChEBI | 18237 | ||
| |||
| |||
| InChIKey | WHUUTDBJXJRKMK-UHFFFAOYSA-N | ||
| UNII | 61LJO5I15S | ||
| ChEMBL | 276389. | ||
| Kémiai és fizikai tulajdonságok | |||
| Kémiai képlet | C5H9NO4 | ||
| Moláris tömeg | 147,13 g/mol | ||
| Megjelenés | fehér, kristályos por | ||
| Sűrűség | 1,4601 g/cm³ (20 °C) | ||
| Olvadáspont | 199 °C (bomlik) | ||
| Oldhatóság (vízben) | 8,64 g/l (25 °C-on)[1] | ||
| Oldhatóság | 0,00035 g/100 g etanol (25 °C-on)[2] | ||
| Savasság (pKa) | 2,1; 4,07; 9,47[3] | ||
| Veszélyek | |||
| NFPA 704 | |||
| Ha másként nem jelöljük, az adatok az anyag standardállapotára (100 kPa) és 25 °C-os hőmérsékletre vonatkoznak. | |||
A glutaminsav egy aminosav (rövidítése Glu vagy E). Anionja a glutamát. Egyike a 20 fehérjealkotó aminosavnak. Nem tartozik az esszenciális aminosavak közé, azaz az emberi szervezet is elő tudja állítani. Az emberi szervezet szabadaminosav-tartalmának legnagyobb részét teszi ki. A GAA és a GAG tripletek kódolják.
Ahogy neve is jelzi, oldalláncához karboxilcsoport kapcsolódik. Semleges (7-es) pH értéknél az amino-csoporthoz egy proton kapcsolódik, valamint az egyik, vagy mindkét karboxilcsoport ionizálódik. Az így keletkezett vegyület egyszeres negatív töltéssel rendelkezik, és glutamát a neve. A glutaminsav pKa értéke 4,1, azaz ennél kisebb pH-érték mellett a karboxilcsoportoknak kevesebb mint fele ionizálódik.
Szerepe
szerkesztésA glutamin alapvető szerepet játszik a stresszre adott szervezeti válaszreakciókban, ennél fogva hiánya következtében sérül a szervezet védekezőkészsége. A glutamin ugyanis kulcsszerepet játszik számos metabolikus és immunológiai folyamatban, ezenkívül a legfontosabb energiaforrás a gyorsan osztódó sejtek, mint enterociták, limfociták számára, csökkenti a gyulladáskeltő és fokozza az gyulladáscsökkentő gyulladásos mediátorok termelődését, fokozza a sejt immunitást. A legfontosabb celluláris antioxidáns, a glutation prekurzora. Ezenkívül fokozza a bélnyálkahártya barrierfunkcióját.
Bioszintézise
szerkesztés| Kezdeti anyagok | Keletkezett anyagok | Enzimek |
|---|---|---|
| Glutamin + H2O | → Glu + NH3 | GLS, GLS2 |
| NAcGlu + H2O | → Glu + Acetát | (nem ismert) |
| α-ketoglutarát + NADPH + NH+4 | → Glu + NADP+ + H2O | GLUD1, GLUD2 |
| α-ketoglutarát + α-aminosav | → Glu + α-oxosav | transzamináz |
| 1-pirrolin-5-karboxilát + NAD+ + H2O | → Glu + NADH | ALDH4A1 |
| N-formimino-L-glutamát + FH4 | → Glu + 5-formimino-FH4 | FTCD |
Felhasználása és hatásmechanizmusa
szerkesztésLebontás
szerkesztésA glutamát kulcsfontosságú eleme a sejtszinten történő lebontásnak. Az emberi szervezet az elfogyasztott fehérjét első körben aminosavakká bontja, majd ezekből építi fel a számára szükséges fehérjéket. Az aminosavvá való bontás kulcseleme a transzamináció, amikor az aminosav aminocsoportja átadódik egy α-ketosavnak, általában egy transzamináznak nevezett enzim segítségével:
- R1-aminosav + R2-α-ketosav ⇌ R1-α-ketosav + R2-aminosav
Egy nagyon általános α-ketosav az α-ketoglutarát (más néven alfa-ketoglutársav), a citromsavciklus fontos eleme. Az α-ketoglutarát transzaminációjával glutamát keletkezik. Általában a reakció eredményeként létrejövő α-ketosav is hasznos vegyület.
- Alanin + α-ketoglutarát ⇌ piroszőlősav + glutamát
- Aszparaginsav + α-ketoglutarát ⇌ oxálacetát + glutamát
A piroszőlősav és az oxálacetát egyaránt fontos összetevői a glikolízisnek, valamint a citromsavciklusnak is.
A glutamát fontos szerepe, hogy a szervezetben található káros nitrogén eltávolításában nagy szerepet játszik. Deaminálódik, és ez által egy a glutamát-dehidrogenáz nevű enzim által katalizált, oxidatív reakció jön létre.
Ezt követően az ammónia főként urea formában (mely a májban szintetizálódik) kerül ürítésre.
Szerepe neurotranszmitterként
szerkesztésA glutamát az emlősök idegrendszerében található legáltalánosabb serkentő neurotranszmitter. Nem tud átjutni a vér-agy gáton, így az anyagcserében részt vevő glutaminsav elkülönül a neurotranszmissziót végző glutaminsavtól. Ez utóbbi szintézise az agyban történik α-ketoglutársavból reduktív transzaminálással, vagy a glutamin dezaminálásával, és a neurális szinapszisok preszinaptikus sejtjében, a glutamát vezikulákban tárolódik. Az akciós potenciál hatására a vezikulák tartalma az intercelluláris térbe kerül, és aktiválja a posztszinaptikus sejten található glutamátreceptorokat (pl. NMDA receptor). A tanulás folyamatában, és a memória kialakulásában a glutamát nagy szerepét feltételezik.
Az ioncsatornák és glutaminsav-receptorok nagy többségét az ionotróp receptorok alkotják. A farmakológiai érzékenység alapján három csoportra oszthatók:
A másik glutamát receptortípus a G-fehérjecsatolt metabotróp receptor.
GABA prekurzor
szerkesztésA glutaminsav a gamma-aminovajsav (GABA) prekurzora, azaz szintetizálásához nélkülözhetetlen. A szintetizálás a hasnyálmirigyben, és az agyban nagy mennyiségben található glutaminsav-dekarboxiláz (GAD) nevű enzim hatására megy végbe.
Ízfokozó
szerkesztésAz élelmiszerekben a hozzáadott glutaminsavat E620 jelöli. Az ízfokozóként alkalmazott glutaminsavat általában melaszból, baktériumok erjesztésével készítik legnagyobb mennyiségben, de bármilyen növényi fehérjéből előállítható, mert a glutaminsav és a glutamát szinte minden fehérjében megtalálható. Az anyatejben, a paradicsomban és a szardíniában sok szabad glutamát található.
| Élelmiszer | Szabad glutamát (mg/100 g) | Fehérjében található glutamát (mg/100 g) |
|---|---|---|
| Vegemite (ausztrál szendvicskrém) | 1400 | |
| Szójaszósz (kínai) | 1090 | |
| Szójaszósz (japán) | 782 | |
| Roquefort-sajt | 1280 | |
| Parmezán-sajt | 1200 | 9847 |
| Szőlőlé | 258 | |
| Paradicsom | 140 | 238 |
| Zöldborsó | 200 | 5583 |
| Kukorica | 130 | 1765 |
| Tehéntej | 2 | 819 |
| Anyatej | 22 | 229 |
| Tojás | 23 | 1583 |
| Csirke | 44 | 3309 |
| Kacsa | 69 | 3636 |
| Marhahús | 33 | 2846 |
| Sertéshús | 23 | 2325 |
| Lazac | 20 | 2216 |
A glutaminsav a többi glutamáthoz (pl. nátrium-glutamát) hasonlóan az umami ízt adja, valamint felerősíti az élelmiszerek egyéb ízeit is. Legintenzívebb ízhatása a nátrium-glutamátnak van.
Számos élelmiszerben megtalálható, napi maximum beviteli mennyisége nincs meghatározva.
Előállítása
szerkesztésA kínai Fufeng Group Limited a glutaminsav legnagyobb előállítója, évente körülbelül 300 000 tonnát termel, míg a világ éves felhasználása 1,7 millió tonna, melynek nagy részét (1,1 millió tonnát) Kína használja fel.
Sói
szerkesztés- E621 nátrium-glutamát (MSG)
- E622 kálium-glutamát
- E623 kalcium-diglutamát
- E624 ammónium-glutamát
- E625 magnézium-diglutamát
A glutamátokat (a glutaminsav anionja) nátriummal, kalciumal, káliummal, magnéziummal ammóniával alkotott sóit az élelmiszeriparban széles körben alkalmazzák, mint általános ízfokozókat. Általában keményítőből, cukornádból, cukorrépából, vagy melaszból, erjesztés útján állítják elő őket. Ízük különböző intenzitású, jellegzetes umami íz. Legintenzívebb íze a nátrium-glutamátnak van. Főként alacsony sótartalmú élelmiszerek esetén fordulnak elő. Számos élelmiszerben előfordulhatnak, de leginkább a hús alapú, vagy hús ízű készítményekben alkalmazzák őket.
Számos forrás mellékhatásokról számol be (például az arra érzékenyeknél nyaki és hátfájást, gyengeséget, fejfájást, szapora szívdobogást okozhat, valamint némely források az egyik legveszélyesebb adalékanyagként említik), ugyanakkor tudományos vizsgálatok nem mutattak semmiféle káros mellékhatást. 12 hetesnél fiatalabb csecsemők esetében fogyasztása nem ajánlott. Napi maximum beviteli mennyisége nincs meghatározva.[4][5][6][7][8]
Jegyzetek
szerkesztés- ↑ Archivált másolat. [2017. március 24-i dátummal az eredetiből archiválva]. (Hozzáférés: 2014. augusztus 19.)
- ↑ (2009. február 27.) „Food Chemistry”.
- ↑ Archivált másolat. [1998. február 11-i dátummal az eredetiből archiválva]. (Hozzáférés: 2016. szeptember 6.)
- ↑ Food-Info.net : E-numbers : E621 : Monosodiumglutamate
- ↑ Food-Info.net : E-numbers : E624 : Ammonium glutamate
- ↑ Food-Info.net : E-numbers : E623 : Calcium glutamate
- ↑ Food-Info.net : E-numbers : E624 : Ammonium glutamate
- ↑ Food-Info.net : E-numbers : E625 : Magnesium glutamate
Források
szerkesztés- Smith QR (2000. április). „Transport of glutamate and other amino acids at the blood-brain barrier”. J Nutr. 130 (4S Suppl), 1016S-22S. o. PMID 10736373.
- Nelson DL and Cox MM. Lehninger Principles of Biochemistry, 4th edition
- Okumoto, S., et al. (2005). „Detection of glutamate release from neurons by genetically encoded surface-displayed FRET nanosensors”. Proceedings of the National Academy of Sciences U.S.A 102 (24), 8740-8745. o. PMID 15939876.
- Shigeri Y, Seal RP, Shimamoto K (2004. július). „Molecular pharmacology of glutamate transporters, EAATs and VGLUTs”. Brain Res Brain Res Rev. 45 (3), 250–265. o. PMID 15210307.
- Manev H, Favaron M, Guidotti A, Costa E (1989. július). „Delayed increase of Ca2+ influx elicited by glutamate: role in neuronal death”. Mol Pharmacol. 36 (1), 106–112. o. PMID 2568579.
- Reeds, P.J., et al. (2000). „Intestinal glutamate metabolism”. Journal of Nutrition 130 (4s), 978S-982S. o. PMID 10736365.. Free text
- Corrie, J.E., et al. (1993). „Postsynaptic activation at the squid giant synapse by photolytic release of L-glutamate from a 'caged' L-glutamate”. Journal of Physiology 465 (Jun), 1-8. o. PMID 7901400.
- Corrie JE, DeSantis A, Katayama Y, Khodakhah K, Messenger JB, Ogden DC, Trentham DR (1993. június). „Postsynaptic activation at the squid giant synapse by photolytic release of L-glutamate from a 'caged' L-glutamate”. J Physiol. 465, 1–8. o. PMID 7901400.
- Augustin H, Grosjean Y, Chen K, Sheng Q, Featherstone DE (2007). „Nonvesicular release of glutamate by glial xCT transporters suppresses glutamate receptor clustering in vivo”. Journal of Neuroscience 27 (1), 111-123. o. PMID 17202478.
- Zheng Xi, Baker DA, Shen H, Carson DS, Kalivas PW (2002). „Group II metabotropic glutamate receptors modulate extracellular glutamate in the nucleus accumbens”. Journal of Pharmacology and Experimental Therapeutics 300 (1), 162-171. o. PMID 11752112.
- Ádám–Dux–Faragó–Fésüs–Machovich–Mandl–Sümegi: Orvosi biokémia, 458–459. és 532–535. o. Medicina Könyvkiadó Zrt., 2006 ISBN 963-242-902-8
