Hexazin
| Hexazin | |||
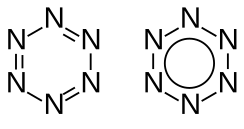 A hexazin Kekulé- és aromás szerkezeti képlete | |||
 A hexazin pálcika- és kalottamodellje | |||
| Szabályos név | hexazin[1] | ||
| Más nevek | hexaazabenzol | ||
| Kémiai azonosítók | |||
|---|---|---|---|
| CAS-szám | 7616-35-5 | ||
| PubChem | 11966278 | ||
| ChemSpider | 10140271 | ||
| ChEBI | 36869 | ||
| |||
| InChIKey | YRBKSJIXFZPPGF-UHFFFAOYSA-N | ||
| Gmelin | 1819 | ||
| Kémiai és fizikai tulajdonságok | |||
| Kémiai képlet | N6 | ||
| Moláris tömeg | 84,04 g/mol | ||
| Ha másként nem jelöljük, az adatok az anyag standardállapotára (100 kPa) és 25 °C-os hőmérsékletre vonatkoznak. | |||
A hexazin a nitrogén hipotetikus allotrop módosulata, képlete N6. Hat nitrogénatomból álló gyűrűs molekula, a benzol olyan analógja, amelyben minden CH-csoport nitrogénatomra van cserélve. Ez lenne az azabenzol (azin) sorozat utolsó tagja. Az azinok olyan vegyületek, amelyekben a benzolgyűrű X számú CH-csoportja nitrogénatomra van cserélve. A sorozat két utolsó tagját, a pentazint és a hexazint még nem észlelték. Az azin sorozat többi tagja – piridin, pirimidin, piridazin, pirazin, triazinok, tetrazinok – ismert vegyületek.
Tulajdonságai
szerkesztésA hexazin molekula szerkezetileg nagyon hasonlít a benzolra, és – a számítások szerint – ahhoz hasonlóan valószínűleg aromás vegyület. Ennek ellenére számítógépes előrejelzések szerint rendkívül instabil, amit a nitrogénatomok nemkötő elektronpárjai közötti taszítás és/vagy a szigma lazítópályára történő elektrondonáció okozhat.[2]
Fordítás
szerkesztésEz a szócikk részben vagy egészben a Hexazine című angol Wikipédia-szócikk ezen változatának fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.
Jegyzetek
szerkesztés- ↑ Hexazine - PubChem Public Chemical Database. The PubChem Project. National Center for Biotechnology Information
- ↑ J. Fabian and E. Lewars (2004). „Azabenzenes (azines) — The nitrogen derivatives of benzene with one to six N atoms: Stability, homodesmotic stabilization energy, electron distribution, and magnetic ring current; a computational study”. Canadian Journal of Chemistry 82 (1), 50–69. o. [2005. március 29-i dátummal az eredetiből archiválva]. DOI:10.1139/v03-178. (Hozzáférés: 2016. február 5.)
Források
szerkesztés- P. Saxe and H. F. Schaefer III (1983). „Cyclic D6h Hexaazabenzene-A Relative Minimum on the N6 Potential Energy Hypersurface?”. Journal of the American Chemical Society 105 (7), 1760–1764. o. DOI:10.1021/ja00345a010.
- H. Huber (1982). „Is Hexazine Stable?”. Angewandte Chemie International Edition 21 (1), 64–65. o. DOI:10.1002/anie.198200641.
- M. N. Glukhovtsev and P. von Ragué Schleyer (1992). „Structures, bonding and energies of N[6] isomers”. Chemical Physics Letters 198 (6), 547–554. o. DOI:10.1016/0009-2614(92)85029-A.
- T.-K. Ha, R. Cimiraglia and M.T. Nguyen (1981). „Can hexazine (N6) be stable?”. Chemical Physics Letters 83 (2), 317–319. o. DOI:10.1016/0009-2614(81)85471-1.