Mielóma multiplex
A mielóma multiplex vagy más néven plazmasejtes mielóma vagy Kahler-betegség az antitesteket termelő plazmasejtekből kiinduló rosszindulatú daganatos betegség.[1] Mielóma multiplexben a tumoros plazmasejtek felhalmozódnak a csontvelőben és károsítják a normális vérképzést, valamint az esetek jelentős részében kóros antitestet, ún. paraproteint termelnek, mely a vesékben lerakódva vesekárosodást okozhat. A betegek kb. 90 százalékában a folyamat a csontokat is érinti, gyakoriak a csontfájdalmak, patológiás csonttörések pedig a betegek kb. 60 százalékában fordulnak elő.[2]
| Mielóma multiplex | |
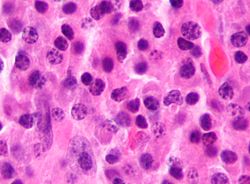 | |
| Mielóma multiplex szövettani megjelenése. | |
| 'Szinonimák | Plazmasejtes mielóma, Kahler betegség |
| Latinul | Myeloma multiplex |
| Angolul | Multiple myeloma, Plasma cell myeloma, Myelomatosis |
| Osztályozás | |
| BNO-10 | C90.0 |
| BNO-9 | 203.0 |
| ICDO | M9732/3 |
| ' | ... |
| Adatbázisok | |
| OMIM | 254500 |
| DiseasesDB | 8628 |
| MedlinePlus | 000583 |
| eMedicine | med/1521 |
| MeSH ID | D009101 |
A Wikimédia Commons tartalmaz Mielóma multiplex témájú médiaállományokat. | |
A betegség diagnosztikájában a vér- és vizeletvizsgálatokkal (pl. szérum és vizelet fehérje elektroforézis) kimutatható az abnormális paraprotein jelenléte, illetve a magas vér kalcium szint, amely gyakori velejárója a betegségnek. Fontos még a csontvelő szövettani vizsgálata, illetve a különböző képalkotó vizsgálatok, különösen a csontérintettségek felderítésében.
A betegség kezelésére klasszikus kemoterápiás szereket, szteroidokat, proteaszóma inhibitorokat, immunmoduláns szereket és csontvelő átültetést alkalmaznak. A csontfájdalmak enyhítésére esetenként sugárkezelést végeznek, a törések pedig sebészi beavatkozásokat tehetnek szükségessé.[3]
A betegséget gyakorlatilag gyógyíthatatlannak tartják,[4] azonban a terápiák fejlődésével a betegek túlélése egyre jobban kitolódott, az 5 éves várható túlélés a konvencionális kezelések mellett a fejlett nyugati világban kb. 45 százalék,[5][6] a 10 éves pedig 30 százalék körüli.[6]
Epidemiológia
szerkesztésA mielóma multiplex az összes daganatos megbetegedés kb. 1 százalékát teszi ki, azonban a hematológiai neopláziák 10 százaléka mielóma, ezzel a non-Hodgkin limfómák után a második leggyakoribb hematológiai daganatnak számít.[5] Az összes daganatos halálozás 2 százalékáért felelős.[5]
Elsősorban az időskor betegsége, a betegek 98 százaléka 40 év feletti, az átlagéletkor 69 év.[5] Incidenciája a földrajzi helyzettől és rassztól függően változik, Európában, Amerikában, Ausztráliában magasabb, Ázsiában ritkábban fordul elő.[7] Az Egyesült Államokban 2007 és 2011 között 6,1/100.000 fő volt az éves előfordulás, az afroamerikaiakban kétszer gyakrabban fordul elő, mint a kaukázusi fehér rasszban, ahol 4/100.000 incidenciát mutat.[8] Nemek szerinti eloszlását tekintve férfiakban valamivel gyakoribb.[5] Gyakorisága növekvő tendenciát mutat, 1990-ben világszerte 49.000 mielómás haláleset fordult elő, 2010-ben ez a szám már 74.000 volt.[9]
A betegség kialakulásának oka ismeretlen,[10] azonban egyes családokban halmozottan fordul elő.[11]
Tünetek
szerkesztésA mielóma multiplex több szervrendszert érintő, változatos tünettannal rendelkezik, amit nagyban befolyásol a termelt paraprotein mennyisége és típusa. A leggyakoribb tüneteket az angol CRAB rövidítés foglalja össze (C=emelkedett kalcium, R=renális elégtelenség, A=anémia, B=csont léziók).[12]
Csontérintettség
szerkesztésA betegek kb. 90 százalékában van csontérintettség.[2] A mielómás gócokra a csont felszívódása jellemző (oszteolízis), képalkotó vizsgálatokkal rendszerint több, éles szélű, kerek csonthiány látható. A csont felszívódásának mechanizmusa nem minden részletében ismert, de az már bizonyított, hogy a mielómás tumorsejtek a csontok bontását fokozó anyagokat (pl. citokineket) termelnek.[13] Szintén bizonyítást nyert, hogy jelentős mennyiségű szolubilis RANKL-t (angolul: Receptor Activator for Nuclear Factor κ B Ligand) képesek termelni, ami ugyancsak a csontokat bontó oszteoklasztokat aktiválja.[14] A csontok bontása miatt gyakori tünetek a hát- és derékfájdalmak, patológiás csonttörések, különösen a csigolyák összeroppanása. A csonttünetek fontosságát jól szemlélteti, hogy a betegek 70 százalékában a mozgásszervi panaszok, csontfájdalmak az első, a betegek által is észlelt tünetek,[15] illetve a következményes fájdalom és rokkantság jelentősen rontja a mielómás betegek életminőségét. A csontok felszívódása során nagy mennyiségű kalcium szabadul fel, mely a vér kalcium szint következményes emelkedésével és más szervi tünetek megjelenésével jár.
Vérszegénység
szerkesztésVérszegénység (anémia) a mielómás betegek kétharmadában jelentkezik.[16] Legfőbb oka a csontvelői vérképző sejtek kiszorítása a tumorsejtek által. Ismert, hogy a mielómasejtek több olyan citokint is termelnek (pl. IL-1, TNFα), amik csökkentik a csontvelői vörösvérsejtképzést,[16] emellett a mielómában szintén gyakori vesekárosodás következtében csökken a vesékben a vérképzést fokozó eritropoetin hormon termelése.[17] A vérszegénység a betegekben fáradékonyságot, általános gyengeséget, nehézlégzést és szapora szívdobogásérzést okozhat. A vérszegénység eritropoetin hormon adásával rendszerint kezelhető.[18]
Vesekárosodás
szerkesztésMielóma multiplexben a vesék több ok miatt is károsodnak és a betegek durván felében alakul kis súlyos veseérintettség.[19] Egyrészt a daganatos plazmasejtek kóros paraproteint (teljes immunglobulin molekulákat vagy csak annak könnyű láncát) termelnek. Ezek a keringésből a vesékbe jutnak, ahol lerakódnak, illetve méretüktől függően egy részük bekerül a vizeletbe.[20] A lerakódó paraprotein a glomeruláris és tubuláris bazális membrán megvastagodásához, a tubulusok elzáródásához és a nefronok heges átalakuláshoz vezet.[21] A tumorsejtek által termelt könnyűláncok emellett gyakran szisztémás AL típusú amiloidózist okoznak, ami a veséken kívül többek között a szívet, az emésztőrendszert és a tüdőket károsítja.[22] A csontok bontása során felszabaduló kalcium a vesékben nefrokalcinózist okozva ugyancsak hozzájárul a vesefunkciók csökkenéséhez.[19]
A veseérintettség klinikailag csökkent vesefunkciókban (pl. emelkedett szérum kreatinin) és fehérje vizelésben nyilvánul meg.[23]
Fertőzések
szerkesztésA mielómás betegekben a csökkent immunfunkciók miatt gyakoriak a fertőzések, amelyek egyben a betegség leggyakoribb közvetlen halálokait képezik.[24] Leggyakrabban Gram-pozitív baktériumok általi fertőzések (pl. Streptococcus pneumoniae okozta tüdőgyulladás) fordulnak elő.[25]
A mielómára jellemző immunhiány is többféle mechanizmussal alakul ki. Egyrészt a B-sejtek funkciózavara következtében csökkent a normális immunglobulinok termelése (poliklonális hipogammaglobulinémia).[26] A csökkent ellenanyag szintek kedveznek a tokos baktériumok (pl. Pneumococcus, Hemophilus influenzae) okozta fertőzéseknek. Emellett leírták a helper T-sejtek aránytalanságait[27] és más immunológiai eltéréseket is. A fertőzéseknek kedvez még a betegség terápiájában használt kemoterápiás és immunmoduláló szerek alkalmazása is.[28]
Idegrendszeri tünetek
szerkesztésMielóma multiplexben sokféle neurológiai tünet jelentkezhet, a leggyakrabban a környéki idegrendszer érintett.[29] A betegség során gyakoriak a különböző ideggyökök összenyomásából eredő fájdalmak, aminek legfőbb oka a csigolyák daganatos érintettsége, illetve az annak következtében esetlegesen kialakuló csigolyatörések. A betegek egy részében gerincvelői kompresszió alakul ki, ami erős hátfájással, a végtagok gyengülésével vagy bénulásával járhat.[29][30] A daganatos plazmasejtek által termelt paraprotein és a vér viszkozitásának következményes növekedése, a vér magas kalcium szintje, a csökkent vesefunkciók következtében felhalmozódó anyagcseretermékek szintén idegrendszeri tüneteket okozhatnak.[31] Jellemző panaszok a fejfájás, a látászavarok, valamint a fáradékonyság és a koncentrációképesség csökkenése, utóbbiak megjelenésében a társuló vérszegénység is szerepet játszik.
Diagnosztika
szerkesztésA mielóma multiplex diagnosztikájában alapvető a vér és a vizelet laborvizsgálata, a csontvelő szövettani vizsgálata, illetve a csontérintettség felmérése képalkotó vizsgálatokkal.[32]
Laborvizsgálatok
szerkesztésA rutin vérvizsgálat során kimutatható a vérszegénység, a csökkent vesefunkciók, illetve a jelentősen gyorsult vérsejtsüllyedés, mely utóbbi a termelt paraproteinek következménye, akárcsak a vér összfehérje tartalmának növekedése. A vérszérumból végzett elektroforézis jellegzetes kóros, keskeny fehérjetöbbletet mutat az immunglobulinoknak megfelelő gamma frakcióban (monoklonális M-csúcs, monoklonális gammopátia), amely immunfixációval igazolhatóan monoklonális ellenanyagfelhalmozódás (paraprotein), vagyis egyetlen daganatos plazmasejt klónjainak terméke. A kóros paraprotein megjelenhet a vizeletben is (ún. Bence Jones fehérje), mely a vizeletből készült elektroforézissel kimutatható. Előfordul, hogy a daganatos plazmasejtek nem termelnek paraproteint, ekkor ún. nem-szekretoros mielóma multiplexről (NSMM) beszélnek, ami ritka variáns, az összes mielómás eset kb. 1-5 százalékát teszi ki.[33] A diagnózist ilyenkor nehezíti, hogy nem mutatható ki monoklonális gammopátia a vérben, illetve kóros paraprotein a vizeletben.[34] Amennyiben monoklonális ellenanyagtöbblet van jelen a betegben, de nem mutatható semmilyen szervi eltérés és a csontvelő szövettani vizsgálata is negatív, akkor ún. nem meghatározott jelentőségű monoklonális gammopátiáról (MGUS) beszélnek, amelyet a betegség előalakjának tartanak, évente az ilyen betegek kb. 1 százalékában jelenik meg mielóma multiplex.[35]
A daganatos plazmasejtek nagy számban megjelenthetnek a vérben is plazmasejtes leukémiát okozva, ami egy ritka, nehezen kezelhető és rossz prognózisú altípus.[36]
Képalkotó vizsgálatok
szerkesztésA képalkotó vizsgálatokat a csontérintettség kimutatására használják, ami a betegség stádiummeghatározásának egyik fontos eleme. Éppen ezért mielóma multiplexben az egész testet lefedő vizsgálatokra van szükség a csontrendszerről. A közönséges röntgenfelvétel a legrégebb óta elérhető vizsgálat, melyen éles szélű, sokszor csoportosan elhelyezkedő csonthiányok (oszteolítikus gócok), illetve diffúz csontritkulás (oszteoporózis) láthatók. A CT az előbbinél érzékenyebb módszer, kisebb elváltozások is detektálhatók a segítségével, és megvan az az előnye, hogy egyetlen vizsgálattal leképezhető az egész test, ugyanakkor nagyobb sugárterhelést jelent a betegnek.[37] Az MRI is alkalmazható vizsgálóeljárás, mellyel különösen a gerincvelő vagy a kilépő ideggyökök összenyomásának mértéke határozható meg jól,[38] illetve képes a csontvelőben található mielómás gócokat elkülöníteni az ép csontvelőtől akkor is, ha még nem alakult ki csontlézió.[39] További előnye, hogy egyáltalán nem jár sugárterheléssel. Az izotópdiagnosztikai módszerek közül alkalmazzák a 99mTc-sestamibi szcintigráfiát, illetve a PET-et, amely utóbbihoz 18-FDG radiofarmakont használnak. A CT-t és a PET-et egyesítő PET-CT vizsgálat is végezhető, bár mielómában jelenleg nem tartozik a rutin diagnosztikai módszerek közé.[40]
A 2009-es nemzetközi ajánlás szerint mielómában kötelező a csontok radiológiai vizsgálata, minimum követelményként a mellkas, a koponya, a nyaki, mellkasi és ágyéki gerinc, a medence, valamint a felkar- és combcsontok, illetve panasz esetén a panaszos terület vizsgálatát említik.[37]
Mikroszkopikus leírás
szerkesztésA WHO a plazmasejtes daganatokat, beleértve a plazmasejtes mielómát is, az érett B-sejtes non-Hodgkin limfoid neopláziák közé sorolja.[41] Szövettanilag a tumor plazmasejtek csoportjaiból álló ún. plazmocitóma. A csontvelőben normálisan is találhatók plazmasejtek, melyek rendszerint néhány sejtből álló kisebb csoportokat képeznek elszórtan a csontvelő állományában. Ezzel szemben a mielómás plazmasejtek sok sejtből álló csomókat képeznek, és kiszorítják a normális vérképző elemeket. Amennyiben a csontvelői sejtek több mint 10 százaléka monoklonális plazmasejt, mielóma multiplex diagnosztizálható,[42] azonban a WHO a diagnózishoz szükséges minimális számot nem határoz meg, mivel a tünetekkel is rendelkező mielómás betegek kb. 5 százalékában 10 százalék alatti a plazmasejtek aránya a csontvelőben.[41] Plazmocitóma nem csak a csontvelőben lehet, a lágyrészekben is megjelenhet. A tumorban érett, éretlen és anaplasztikus plazmasejtek egyaránt előfordulhatnak.
A mielómasejtek kóros ellenanyagot (paraprotein) termelnek, amely kimutatható a citoplazmájukban, azonban a sejtfelszínen nem jelenik meg. Ezek sokszor zárványokat képeznek a citoplazmában (Russel testek) és a sejtmagban (Dutcher testek). Mivel mindegyik tumorsejt egyetlen kóros plazmasejt utódja, az összes által termelt ellenanyag azonos, vagyis egymással megegyező izotípusú nehéz és könnyű láncokból állnak. Az esetek 85 százalékában a tumorsejtek mind nehéz, mind könnyű láncot termelnek, 15 százalékban azonban csak könnyű láncot. Mivel a daganatsejtek által termelt immunglobulin könnyű lánca azonos izotípusú, ennek kimutatása immunológiai módszerrel (pl. immunhisztokémia vagy áramlási citometria) igazolja a monoklonalitást. A diagnózisban és az egyéb tumorok elkülönítésében segít még a sejtek immunfenotípusának ismerete, vagy annak meghatározása, hogy milyen molekulák találhatók a sejtek felszínén és a citoplazmájukban, amire leginkább az áramlási citometriai vizsgálat alkalmas.[43] A normális plazmasejtekkel ellentétben CD38, CD138 és CD56 pozitivitással bírnak, emellett az egészséges plazmasejtekre jellemző antigének közül a mielómasejtek nem, vagy csak gyengén expresszálják a CD19 és CD20 molekulákat.[44][45]
Genetikai eltérések
szerkesztésMielóma multiplexben gyakoriak a különböző genetikai aberrációk, fluoroszcens in situ hibridicázióval (FISH) vizsgálva gyakorlatilag minden esetben kimutatható valamilyen kromoszóma hiba.[46] A számbeli eltérések közül mono- és triszómiák egyaránt előfordulhatnak. Genetikai szinten alapvetően két csoportot különböztetnek meg, a hiperdiploid, azaz a normálisnál nagyobb DNS tartalmú formát (h-MM) és nem-hiperdiploid (nh-MM) mielómát.[47] Előbbire inkább számbeli eltérések, azon belül is főleg triszómiák jellemzőek és kedvezőbb kórlefolyással társul, míg utóbbit a strukturális kromoszóma hibák, elsősorban a transzlokációk jellemzik, és rosszabb prognózist valószínűsít a beteg számára.[47] A ploiditás stabilnak tekinthető, a betegség lefolyása alatt nem változik.[48]
A 13-as kromoszóma deléciója és monoszómiája a betegek felében van jelen, és rossz prognózist valószínűsít, bár ebben nem magának a hibának van szerepe, hanem annak, hogy gyakran társul a kedvezőtlen kromoszóma transzlokációkkal jellemezhető nem-hiperdiploid mielómával (nh-MM).[47] A p53 tumor szuppresszor gént érintő 17p13 deléció a betegegek 10 százalékában van jelen és egyértelműen rossz prognózist jelent.[49]
Transzlokációk közül kiemelendő a t(4;14)(p16;q32), ami a 4-es kromoszómán található fibroblaszt növekedési faktor receptor-3 (FGFR3) és a 14-es kromoszómán kódoló immunglobulin nehéz lánc gének egymás mellé kerülésével, következetesen fokozott FGFR3 átírással jár.[50] A t(4;14) transzlokáció a beteg számára kedvezőtlen prognózist, rövidebb várható túlélést valószínűsít.[51] Ugyancsak kedvezőtlen a C-maf gént érintő t(14;16)(q32;q23) transzlokáció, ami a betegek kb. 5-7 százalékában fordul elő.[47]
Szintén fontos a betegek 15 százalékában jelen lévő t(11;14)(q13;q32), ahol a sejtciklus szabályozásában részt vevő ciklin D1 gén transzlokálódik. Ez az eltérés a betegség egy klinikailag viszonylag jól meghatározható altípusára jellemző, azonban a túlélésre nincs érdemben hatással.[52]
A Nemzetközi Mielóma Munkacsoport (angolul: International Myeloma Working Group) 2009-es ajánlásában a diagnózist követően minimum a 17p deléció, a t(4;14) és a t(14;16) transzlokációk vizsgálatát javasolja (pl. FISH módszerrel), mivel ezekről bizonyított, hogy kedvezőtlen kórlefolyást jelentenek.[47]
Diagnosztikus kritériumok
szerkesztés2003-ban egy nemzetközi kritériumrendszer született, mely három fő kategóriát különböztetett meg, a tünetekkel járó mielóma multiplexet, a tünetmentes mielómát, és a nem meghatározható jelentőségű monoklonális gammopátiát (MGUS, angolul: Monoclonal gammopathy of undetermined significance).[53] A plazmasejtes daganatok kritériumait 2009-ben részlegesen átdolgozták.[42]
| A mielóma multiplex és az MGUS diagnosztikai kritériumai:[42] |
|---|
| MGUS (mindháromnak teljesülnie kell) |
| vérszérum monoklonális fehérje < 30 g/l |
| csontvelőben a monoklonális plazmasejtek aránya < 10% |
| CRAB tünetek hiánya (magas kalcium, veseérintettség, vérszegénység, csontléziók) |
| Tünetmentes mielóma multiplex (mindkettőnek teljesülnie kell) |
| vérszérum monoklonális fehérje ≥ 30 g/l és/vagy a csontvelőben a monoklonális plazmasejtek aránya ≥ 10% |
| CRAB tünetek hiánya |
| Tünetekkel járó mielóma multiplex (mindháromnak teljesülnie kell) |
| csontvelőben a monoklonális plazmasejtek aránya ≥ 10% |
| kóros paraprotein jelenléte a vérben/vizeletben (kivétel:nem-szekretoros mielóma) |
CRAB tünetek jelenléte:
|
Stádiumbeosztás
szerkesztésA mielóma multiplex stádiumbeosztására két stádiumbeosztást használnak. 1975-ben publikálták a Durie-Salmon-féle beosztást, amelyet mind a mai napig használnak.[54] Felhasználást limitálja, hogy a csontérintettségek radiológiai megítélése sokszor szubjektív, a vizsgálatot leletező orvos értékelésétől függ. A Durie-Salmon-féle besorolásnál egyszerűbb, nemzetközileg meghatározott stádiumbeosztást 2005-ben dolgozták ki.[55]
| A mielóma multiplex stádiumbeosztásai: | ||
|---|---|---|
| Durie-Salmon-féle besorolás:[54] | ||
| Stádium | Kritérium | |
| I. | Mielómás sejttömeg maximum 600x109/m² és az alábbiak közül mindegyik teljesül: | |
| II. | Mielómás sejttömeg 600x109/m² és 1200x109/m² közötti és sem az I., sem a II. stádiumnak nem felel meg | |
| III. | Mielómás sejttömeg 1200x109/m² feletti és az alábbiak közül legalább egy teljesül:
| |
| A stádiumot még a szérum kreatinin módosítja, A, ha < 173 μmol/l; B, ha > 173 μmol/l. | ||
| A 2005-ös nemzetközi beosztás:[55] | ||
| Stádium | Kritérium | Várható túlélés (hónapok) |
| I. |
|
62 |
| II. |
|
44 |
| III. |
|
29 |
Kezelése
szerkesztésA mielóma multiplexet gyógyíthatatlan kórképnek tartják,[4] a kezelések célja a daganatos plazmasejtek számának és ezáltal a betegség tüneteinek csökkentése, a beteg életminőségének javítása, valamint a túlélésének meghosszabbítása. A mielóma előalakjának számító monoklonális gammopátiát (MGUS), illetve a tünetmentes mielómát általában nem kezelik, csak rendszeres kontollvizsgálatokkal megfigyelik a beteget, és amennyiben aktivizálódik a kórkép, megindítják a kezelést.[56] A mielómás beteg kezelését alapvetően meghatározza, hogy végezhető-e a betegben csontvelő átültetés.[57] A sikeres kezeléseket követően elért hatás időleges, a betegség előbb-utóbb kiújul, mely ismételt kezeléseket tesz szükségessé, a kórkép a terápiák hatására krónikus, vissza-visszatérő jelleget ölthet. A betegség ezalatt sok szövődménnyel járhat, amelyek kiegészítő kezeléseket igényelhetnek. Ezek közül kiemelendőek a fertőzések, illetve a csontrendszert és a veséket érintő komplikációk mellett a hematológiai és a neurológiai szövődmények.[30]
Az új terápiás lehetőségek mellett a mielóma multiplex kezelése meglehetősen költséges és komoly anyagi terhet ró az egészségügyi ellátórendszerekre.[58] Több szerző is hangsúlyozza a terápiás tervek racionalizálásának fontosságát, de abban mindegyik egyetért, hogy a költségcsökkentés nem lehet a kezelésben elsődleges szempont, és arra is rávilágítanak, hogy a legolcsóbb kezelések nem feltétlenül a leggazdaságosabbak is.[58]
A betegség jellegéből adódóan fontos a betegek pszichés és szociális támogatása is.[59]
EMN 2014-es ajánlása
szerkesztésAz Európai Mielóma Hálózat (angolul: European Myeloma Network, EMN) 2014-es terápiás ajánlásában is két fő csoportra osztják az újonnan diagnosztizált betegeket, attól függően, hogy alkalmasak-e csontvelő átültetésre vagy sem.[60] Amennyiben igen, úgy először indukciós kemoterápiás kezelésben részesítik, aminek célja a tumorsejtek elpusztítása, majd ezt követően a betegtől (autológ), vagy egy egészséges donortól (allogén) vérképző (hemopoetikus) őssejteket gyűjtenek. Elméletileg az allogén csontvelő átültetéssel lehetőség van a teljes, végleges gyógyulásra, azonban mivel a betegek többsége idős, és a beavatkozás magas halálozási aránnyal jár, ritkán és csak kiújuló betegség esetén alkalmazzák.[61] Az autológ transzplantáció sokkal kisebb kockázattal jár, kiújulás esetén ismételhető és meghosszabbíthatja a beteg életét, de maradandó gyógyuláshoz nem vezet. A csontvelő átültetést követően ún. konszolidáló kezelést végeznek, melyre elsősorban immunmoduláns szereket (thalidomid, lenalidomid) és proteaszóma gátlókat (bortezomib) javasol az EMN.[60]
A csontvelő átültetésre alkalmatlan betegeknél az EMN hosszabb (6-9 ciklus) indukciós kemoterápiát javasol, amelyre többek között az MPT (melfalán, prednizolon, thalidomid) és VMP (bortezomib, melfalán, prednizolon) kombinációkat tartják alkalmasnak,[62][63] fenntartó kezelésként pedig a thalidomid, lenalidomid, bortezomib gyógyszerek jönnek számításba.[60]
Csontérintettségek kezelése
szerkesztésA betegek csontlézióinak kezelésére 2013-ban született nemzetközi ajánlás.[64] A mielómás betegek jelentős részében van csontérintettség, mely jelentősen rontja a betegek életminőségét, és megrövidíti a túlélést is. A csontrendszer erősítésére biszfoszfonát kezelést javasolnak minden terápiában részesülő mielómás betegnek, függetlenól attól, hogy radiológiailag kimutatható-e csontérintettség.[64] Kompressziós csigolyatörésekból adódó jelentős idegi fájdalom esetén ballonos csigolyaplasztikát (kifoplasztika) ajánlanak, amelynek során a törött csigolyába ballont helyeznek, és azt feltöltve szüntetik meg a csigolya deformitását és az idegek összenyomásából eredő fájdalmat.[65] A fájdalomcsillapítás másik lehetősége az érintett terület kis dózisú (maximum 30 Gy) besugárzása,[66] melyet azonban a 2013-as ajánlásban csak más módon nem csökkenthető panaszok esetén javasolnak.[64] Sebészi kezelésre a súlyos, gerinc instabilitással járó csigolyatörések és a hosszú csöves csontok törései esetén lehet szükség, amely ilyenkor hematológus és ortopéd sebész szakorvos együttműködésével történik.[64]
Mellékhatások
szerkesztésA mielóma kezelésére használt szerek is rendelkeznek mellékhatásokkal. A bortezomib perifériás idegbántalmakat (perifériás polineuropátia) okoz, ami a gyógyszer mellőzését és ezáltal a terápia hatékonyságának csökkenését jelentheti.[67] Emellett a bortezomib jelentős vérlemezkeszám csökkenést okozhat. A thalidomid és lenalidomid növeli a tromboembóliák kialakulásának valószínűségét, ezért a szereket kapó betegeket trombózist megelőző (profilaktikus) kezelésben részesítik.[67]
Prognózis
szerkesztésAz új terápiás lehetőségek ellenére a mielóma multiplex napjainkban még mindig gyógyíthatatlan betegségnek számít,[4] ugyanakkor a pár évtizeddel ezelőtti viszonyokhoz képest jelentősen megváltozott a lefolyása. Amíg régebben csak a szteroidokkal kiegészített kemoterápia állt rendelkezésre, a várható átlagos túlélés 2-3 év volt.[68] Az autológ csontvelő átültetés, az immunmoduláns és proteaszóma gátló gyógyszerek megjelenésével, valamint a szupportív kezelések fejlődésével ez nagyjából megduplázódott (kb. 4 év), és jelentősen javult a betegek életszínvonala is.[4][68] Az összesített 5 éves várható túlélés a fejlett nyugati világban jelenleg 45; a 10 éves 30 százalék körüli,[5][6] de a túlélést befolyásolja beteg életkora és a kísérőbetegségei is, a 44 évnél fiatalabb betegekben az előbbi 70; utóbbi 50 százalék.[69] Újonnan diagnosztizált betegségnél a prognózis szempontjából fontos a stádium meghatározása is.[55]
Története
szerkesztésMár az ókori egyiptomi csontvázakon is találtak mielómára utaló csontelváltozásokat,[70] de az első dokumentált eset egy londoni sebészhez, Samuel Solly-hoz köthető, aki 1844-ben egy olyan 39 éves nőbeteg esetét közölte, akiben súlyos derékfájdalmak és fáradékonyság jelentkezett, később pedig csonttörések alakultak ki, végül a tünetek megjelenése után 4 évvel meghalt.[71] Egy másik hasonló csontbetegségben szenvedő beteg vizeletmintájában Henry Bence Jones nagy mennyiségű fehérjét talált, melyről 1848-ban megjelent cikkében számolt be.[72] A mielóma multiplex elnevezés a Strasbourgban dolgozó J. Von Rustizky orosz patológustól származik, aki egy 1873-as boncolás során többszörös lítikus csonttumorokat talált egy betegben.[73] A kórképre sokáig Kahler betegségként hivatkoztak, a prágai professzor, Otto Kahler tiszteletére, aki 1889-ben közölte egy mielómás betegének híressé vált esetét.[73] 1903-ban az angol Frederick Parkes Weber cikkében felismerte, hogy a vizeletben található fehérjék a csontvelőből származnak, és kimutatásuk esetén mielóma fennállása valószínűsíthető.[74]
A normális plazmasejtek mikroszkopikus jellemzőit a magyar Marschalkó Tamás írta le 1895-ben.[73] Az amerikai James Horner Wright 1900-ban vetette fel először, hogy a mielóma a plazmasejtekből indul ki.[75] A vérszérum fehérjéinek elektroforetikus elválasztását a svéd Arne Tiselius dolgozta ki az 1930-as években, aki az albuminon kívül alfa, béta és gamma globulin frakciókat különített el.[73] A módszert mielómás betegek vizsgálatára először Lewis G. Longsworth használta, aki az 1939-ben megjelent publikációjában számolt be a mielómára jellemző, gamma frakcióban detektálható keskeny fehérjecsúcsról.[76] 1961-ben a svéd Jan Gösta Waldenström jellemezte az elektroforézissel leírt mono- és poliklonális hipergammaglobulinémiákat, előbbit elsősorban daganatos betegségekkel hozta összefüggésbe, míg utóbbit inkább gyulladásos jelenségnek tartotta.[77] Mivel nem minden monoklonális fehérjetöbblettel járt klinikailag tumor, bevezette a "jóindulatú monoklonális fehérje" (angolul: benign monoclonal protein) fogalmát, amelyet ma az MGUS-al társítanak.[73]
Állatokban
szerkesztésA betegség nem csak emberben fordul elő, kialakulhat kutyákban,[78] macskákban,[79] lovakban,[80] rágcsálókban, amit a betegség kísérleti körülmények közötti tanulmányozására is felhasználnak, például in vivo egérmodelleken.[81]
A különböző állati nem-szekretoros mielóma (NSMM) sejtvonalaknak komoly biotechnológiai jelentősége van, mivel a monoklonális antitestek előállításához szükséges hibridómák létrehozása ezek segítségével történik.[82]
Ajánlott irodalom, külső linkek
szerkesztés- (en) Swerdlow S.H., Campo E., Harris N.L., Jaffe E.S., Pileri S.A., Stein H., Thiele J., Vardiman J.W. (szerk.): WHO Classification of Tumours of Haematopoietic and Lymphoid Tissues (Fourth Edition), International Agency for Research on Cancer, 2008. Lyon, ISBN 978-92-832-2431-0
- (en) Thomas Moehler, Hartmut Goldschmidt (szerk.): Multiple Myeloma, Springer, 2011. Verlag Berlin Heidelberg, ISBN 978-3-540-85771-6
- Daganatok.hu: Lehetőségek a mielóma multiplex kezelésére
- A Magyar Hematológiai és Transzfúziológiai Társaság honlapja
- A Magyar Onkohematológiai Betegekért Alapítvány hivatalos honlapja
- International Myeloma Working Group honlapja (angol)
Jegyzetek
szerkesztés- ↑ Raab MS, Podar K, Breitkreutz I, Richardson PG, Anderson KC (2009. July). „Multiple myeloma” (angol nyelven). Lancet 374 (9686), 324–39. o. DOI:10.1016/S0140-6736(09)60221-X. PMID 19541364.
- ↑ a b Roodman GD. (2010. February). „Pathogenesis of myeloma bone disease.” (angol nyelven). J Cell Biochem. 109 (2), 283-91. o. DOI:10.1002/jcb.22403. PMID 20014067.
- ↑ Terpos E, Berenson J, Raje N, Roodman GD. (2014. February). „Management of bone disease in multiple myeloma.” (angol nyelven). Expert Rev Hematol. 7 (1), 113-25. o. DOI:10.1586/17474086.2013.874943. PMID 24433088.
- ↑ a b c d San-Miguel JF, Mateos MV. (2011. September). „Can multiple myeloma become a curable disease?” (angol nyelven). Haematologica. 96 (9), 1246-8. o. DOI:10.3324/haematol.2011.051169. PMID 21880640.
- ↑ a b c d e f Myeloma—SEER Stat Fact Sheets (angol nyelven). Seer.cancer.gov. (Hozzáférés: 2014. július 12.)
- ↑ a b c Cancer Research UK: Myeloma statistics (angol nyelven). Cancer Research UK. [2014. július 14-i dátummal az eredetiből archiválva]. (Hozzáférés: 2014. július 5.)
- ↑ Parkin DM, Bray F, Ferlay J, Pisani P. (2005. March-April). „Global cancer statistics, 2002.” (angol nyelven). CA Cancer J Clin. 55 (2), 74-108. o. PMID 15761078.
- ↑ Greenberg AJ, Vachon CM, Rajkumar SV. (2012. April). „Disparities in the prevalence, pathogenesis and progression of monoclonal gammopathy of undetermined significance and multiple myeloma between blacks and whites.” (angol nyelven). Leukemia. 26 (4), 609-14. o. DOI:10.1038/leu.2011.368. PMID 22193966.
- ↑ Lozano R, Naghavi M, Foreman K, et al. (2012. December). „Global and regional mortality from 235 causes of death for 20 age groups in 1990 and 2010: a systematic analysis for the Global Burden of Disease Study 2010.” (angol nyelven). Lancet. 380 (9859), 2095-128. o. DOI:10.1016/S0140-6736(12)61728-0. PMID 23245604.
- ↑ Alexander DD, Mink PJ, Adami HO, Cole P, Mandel JS, Oken MM, Trichopoulos D. (2007). „Multiple myeloma: a review of the epidemiologic literature.” (angol nyelven). Int J Cancer. 120 (Suppl 12), 40-61. o. DOI:10.1002/ijc.22718. PMID 17405120.
- ↑ Koura DT, Langston AA. (2013. August). „Inherited predisposition to multiple myeloma.” (angol nyelven). Ther Adv Hematol. 4 (4), 291-7. o. DOI:10.1177/2040620713485375. PMID 23926460.
- ↑ Talamo G, Farooq U, Zangari M, Liao J, Dolloff NG, Loughran TP Jr, Epner E. (2010. December). „Beyond the CRAB symptoms: a study of presenting clinical manifestations of multiple myeloma.” (angol nyelven). Clin Lymphoma Myeloma Leuk. 10 (6), 464-8. o. DOI:10.3816/CLML.2010.n.080. PMID 21156463.
- ↑ Oranger A, Carbone C, Izzo M, Grano M. (2013. August). „Cellular mechanisms of multiple myeloma bone disease.” (angol nyelven). Clin Dev Immunol. 72013, 289458. o. DOI:10.1155/2013/289458. PMID 23818912.
- ↑ Buckle CH, De Leenheer E, Lawson MA, Yong K, Rabin N, Perry M, Vanderkerken K, Croucher PI. (2012. August). „Soluble rank ligand produced by myeloma cells causes generalised bone loss in multiple myeloma.” (angol nyelven). PLoS One. 7 (8), e41127. o. DOI:10.1371/journal.pone.0041127. PMID 22952578.
- ↑ Tosi P. (2013). „Diagnosis and treatment of bone disease in multiple myeloma: spotlight on spinal involvement.” (angol nyelven). Scientifica (Cairo). 2013, 104546. o. DOI:10.1155/2013/104546. PMID 24381787.
- ↑ a b Mittelman M. (2003. August). „The implications of anemia in multiple myeloma.” (angol nyelven). Clin Lymphoma. 4 (Suppl 1), s23-9. o. PMID 14556675.
- ↑ Ludwig H, Pohl G, Osterborg A. (2004. April). „Anemia in multiple myeloma.” (angol nyelven). Clin Adv Hematol Oncol. 2 (4), 233-41. o. PMID 16163188.
- ↑ Dammacco F, Luccarelli G, Prete M, Silvestris F. (2002). „The role of recombinant human erythropoietin alpha in the treatment of chronic anemia in multiple myeloma.” (angol nyelven). Rev Clin Exp Hematol. Suppl. 1, 32-8. o. PMID 12735213.
- ↑ a b Clark AD, Shetty A, Soutar R. (1999. June). „Renal failure and multiple myeloma: pathogenesis and treatment of renal failure and management of underlying myeloma.” (angol nyelven). Blood Rev. 13 (2), 79-90. o. PMID 10414944.
- ↑ Herrera GA. (2000. June). „Renal manifestations of plasma cell dyscrasias: an appraisal from the patients' bedside to the research laboratory.” (angol nyelven). Ann Diagn Pathol. 4 (3), 174-200. o. PMID 10919389.
- ↑ Ronco P, Plaisier E, Mougenot B, Aucouturier P. (2006. November). „Immunoglobulin light (heavy)-chain deposition disease: from molecular medicine to pathophysiology-driven therapy.” (angol nyelven). Clin J Am Soc Nephrol. 1 (6), 1342-50. o. PMID 17699367.
- ↑ Suzuki K. (2012. October). „Diagnosis and treatment of multiple myeloma and AL amyloidosis with focus on improvement of renal lesion.” (angol nyelven). Clin Exp Nephrol. 16 (5), 659-71. o. DOI:10.1007/s10157-012-0684-5. PMID 22968855.
- ↑ Ganeval D, Lacour B, Chopin N, Grünfeld JP. (1990. November). „Proteinuria in multiple myeloma and related diseases.” (angol nyelven). Am J Nephrol. 10 (Suppl 1), 58-62. o. PMID 2124083.
- ↑ Nucci M, Anaissie E. (2009. July). „Infections in patients with multiple myeloma.” (angol nyelven). Semin Hematol. 46 (3), 277-88. o. DOI:10.1053/j.seminhematol.2009.03.006. PMID 19549580.
- ↑ Kalambokis GN, Christou L, Tsianos EV. (2009. August). „Multiple myeloma presenting with an acute bacterial infection.” (angol nyelven). Int J Lab Hematol. 31 (4), 375-83. o. DOI:10.1111/j.1751-553X.2009.01154.x. PMID 19486365.
- ↑ Hargreaves RM, Lea JR, Griffiths H, Faux JA, Holt JM, Reid C, Bunch C, Lee M, Chapel HM. (1995. March). „Immunological factors and risk of infection in plateau phase myeloma.” (angol nyelven). J Clin Pathol. 48 (3), 260-6. o. PMID 7730490.
- ↑ Ogawara H, Handa H, Yamazaki T, et al. (2005. February). „High Th1/Th2 ratio in patients with multiple myeloma.” (angol nyelven). Leuk Res. 29 (2), 135-40. o. PMID 15607360.
- ↑ Nucci M, Anaissie E. (2009. October). „Infections in patients with multiple myeloma in the era of high-dose therapy and novel agents.” (angol nyelven). Clin Infect Dis. 49 (8), 1211-25. o. DOI:10.1086/605664. PMID 19769539.
- ↑ a b Dispenzieri A, Kyle RA. (2005. December). „Neurological aspects of multiple myeloma and related disorders.” (angol nyelven). Best Pract Res Clin Haematol. 18 (4), 673-88. o. DOI:10.1016/j.beha.2005.01.024. PMID 16026744.
- ↑ a b Bladé J, Rosiñol L. (2007. December). „Complications of multiple myeloma.” (angol nyelven). Hematol Oncol Clin North Am. 21 (6), 1231-46. o. DOI:10.1016/j.hoc.2007.08.006. PMID 17996596.
- ↑ Sobol U, Stiff P. (2014. December). „Neurologic aspects of plasma cell disorders.” (angol nyelven). Handb Clin Neurol. 120, 1083-99. o. DOI:10.1016/B978-0-7020-4087-0.00073-5. PMID 24365373.
- ↑ Rajkumar SV. (2013. March). „Multiple myeloma: 2013 update on diagnosis, risk-stratification, and management.” (angol nyelven). Am J Hematol. 88 (3), 226-35. o. DOI:10.1002/ajh.23390. PMID 23440663.
- ↑ Abdalla IA, Tabbara IA. (2002. July). „Nonsecretory multiple myeloma.” (angol nyelven). South Med J. 95 (7), 761-4. o. PMID 12144086.
- ↑ Hamidah NH, Azma RZ, Ezalia E, et al. (2010). „Non-secretory multiple myeloma with diagnostic challenges.” (angol nyelven). Clin Ter. 161 (5), 445-8. o. PMID 20949241.
- ↑ Kyle RA, Therneau TM, Rajkumar SV, Offord JR, Larson DR, Plevak MF, Melton LJ 3rd. (2002. February). „A long-term study of prognosis in monoclonal gammopathy of undetermined significance.” (angol nyelven). N Engl J Med. 346 (8), 564-9. o. DOI:10.1056/NEJMoa01133202. PMID 11856795.
- ↑ Fernández de Larrea C, Kyle RA, Durie BG, et al. (2013. April). „Plasma cell leukemia: consensus statement on diagnostic requirements, response criteria and treatment recommendations by the International Myeloma Working Group.” (angol nyelven). Leukemia. 27 (4), 780-91. o. DOI:10.1038/leu.2012.336. PMID 23288300.
- ↑ a b Dimopoulos M, Terpos E, Comenzo RL, et al. (2009. September). „International myeloma working group consensus statement and guidelines regarding the current role of imaging techniques in the diagnosis and monitoring of multiple Myeloma.” (angol nyelven). Leukemia. 23 (9), 1545-56. o. DOI:10.1038/leu.2009.89. PMID 19421229.
- ↑ Joffe J, Williams MP, Cherryman GR, Gore M, McElwain TJ, Selby P. (1988. May). „Magnetic resonance imaging in myeloma.” (angol nyelven). Lancet. 1 (8595), 1162-3. o. DOI:10.1016/S0140-6736(88)91973-3. PMID 2896977.
- ↑ Baur-Melnyk A, Buhmann S, Dürr HR, Reiser M. (2005. July). „Role of MRI for the diagnosis and prognosis of multiple myeloma.” (angol nyelven). Eur J Radiol. 55 (1), 56-63. o. DOI:10.1016/j.ejrad.2005.01.017. PMID 15950101.
- ↑ Agarwal A, Chirindel A, Shah BA, Subramaniam RM. (2013. April). „Evolving role of FDG PET/CT in multiple myeloma imaging and management.” (angol nyelven). AJR Am J Roentgenol. 200 (4), 884-90. o. DOI:10.2214/AJR.12.9653. PMID 23521465.
- ↑ a b Campo E, Swerdlow SH, Harris NL, Pileri S, Stein H, Jaffe ES. (2011. May). „The 2008 WHO classification of lymphoid neoplasms and beyond: evolving concepts and practical applications.” (angol nyelven). Blood. 117 (19), 5019-32.. o. DOI:10.1182/blood-2011-01-293050. PMID 21300984.
- ↑ a b c Kyle RA, Rajkumar SV. (2009. January). „Criteria for diagnosis, staging, risk stratification and response assessment of multiple myeloma.” (angol nyelven). Leukemia. 23 (1), 3-9. o. DOI:10.1038/leu.2008.291. PMID 18971951.
- ↑ Kumar S, Kimlinger T, Morice W. (2010. September). „Immunophenotyping in multiple myeloma and related plasma cell disorders.” (angol nyelven). Best Pract Res Clin Haematol. 23 (3), 433-51. o. DOI:10.1016/j.beha.2010.09.002. PMID 21112041.
- ↑ Ruiz-Argüelles GJ, San Miguel JF. (1994. July). „Cell surface markers in multiple myeloma.” (angol nyelven). Mayo Clin Proc. 69 (7), 684-90. o. PMID 8015335.
- ↑ Robillard N, Wuillème S, Moreau P, Béné MC. (2014. March). „Immunophenotype of normal and myelomatous plasma-cell subsets.” (angol nyelven). Front Immunol. 5, 137. o. DOI:10.3389/fimmu.2014.00137. PMID 24744760.
- ↑ Zandecki M, Laï JL, Facon T. (1996. August). „Multiple myeloma: almost all patients are cytogenetically abnormal.” (angol nyelven). Br J Haematol. 94 (2), 217-27. o. PMID 8759879.
- ↑ a b c d e Fonseca R, Bergsagel PL, Drach J, et al. (2009. December). „International Myeloma Working Group molecular classification of multiple myeloma: spotlight review.” (angol nyelven). Leukemia. 23 (12), 2210-21. o. DOI:10.1038/leu.2009.174. PMID 19798094.
- ↑ Chng WJ, Winkler JM, Greipp PR, et al. (2006. March). „Ploidy status rarely changes in myeloma patients at disease progression.” (angol nyelven). Leuk Res. 30 (3), 266-71. o. DOI:10.1016/j.leukres.2005.07.004. PMID 16111750.
- ↑ Drach J, Ackermann J, Fritz E, et al. (1998. August). „Presence of a p53 gene deletion in patients with multiple myeloma predicts for short survival after conventional-dose chemotherapy.” (angol nyelven). Blood. 92 (3), 802-9. o. PMID 9680348.
- ↑ Chesi M, Nardini E, Brents LA, Schröck E, Ried T, Kuehl WM, Bergsagel PL. (1997. July). „Frequent translocation t(4;14)(p16.3;q32.3) in multiple myeloma is associated with increased expression and activating mutations of fibroblast growth factor receptor 3.” (angol nyelven). Nat Genet. 16 (3), 260-7. o. DOI:10.1038/ng0797-260. PMID 9207791.
- ↑ Fonseca R, Blood E, Rue M, et al. (2003. June). „Clinical and biologic implications of recurrent genomic aberrations in myeloma.” (angol nyelven). Blood. 101 (11), 4569-75. o. DOI:10.1182/blood-2002-10-3017. PMID 12576322.
- ↑ Fonseca R, Blood EA, Oken MM, et al. (2002. May). „Myeloma and the t(11;14)(q13;q32); evidence for a biologically defined unique subset of patients.” (angol nyelven). Blood. 99 (10), 3735-41. o. DOI:10.1182/blood.V99.10.3735. PMID 11986230.
- ↑ International Myeloma Working Group. (2003. June). „Criteria for the classification of monoclonal gammopathies, multiple myeloma and related disorders: a report of the International Myeloma Working Group.” (angol nyelven). Br J Haematol. 121 (5), 749-57. o. PMID 12780789.
- ↑ a b Durie BG, Salmon SE. (1975. September). „A clinical staging system for multiple myeloma. Correlation of measured myeloma cell mass with presenting clinical features, response to treatment, and survival.” (angol nyelven). Cancer. 36 (3), 842-54. o. PMID 1182674.
- ↑ a b c Greipp PR, San Miguel J, Durie BG, et al. (2005. May). „International staging system for multiple myeloma.” (angol nyelven). J Clin Oncol. 23 (15), 3412-20. o. DOI:10.1200/JCO.2005.04.242. PMID 15809451.
- ↑ Nau KC, Lewis WD. (2008. October). „Multiple myeloma: diagnosis and treatment.” (angol nyelven). Am Fam Physician. 78 (7), 853-9. o. PMID 18841734.
- ↑ Palumbo A, Rajkumar SV, San Miguel JF, et al. (2014. February). „International Myeloma Working Group consensus statement for the management, treatment, and supportive care of patients with myeloma not eligible for standard autologous stem-cell transplantation.” (angol nyelven). J Clin Oncol. 32 (6), 587-600. o. DOI:10.1200/JCO.2013.48.7934. PMID 24419113.
- ↑ a b Cook R. (2008. September). „Economic and clinical impact of multiple myeloma to managed care.” (angol nyelven). J Manag Care Pharm. 14 (7 Suppl), 19-25. o. [2016. március 4-i dátummal az eredetiből archiválva]. PMID 18774882. (Hozzáférés: 2014. július 12.)
- ↑ Lamers J, Hartmann M, Goldschmidt H, Brechtel A, Hillengass J, Herzog W. (2013. April). „Psychosocial support in patients with multiple myeloma at time of diagnosis: who wants what?” (angol nyelven). Psychooncology. 22 (10), 2313-20. o. DOI:10.1002/pon.3284. PMID 23576528.
- ↑ a b c Engelhardt M, Terpos E, Kleber M, et al. (2014. February). „European Myeloma Network recommendations on the evaluation and treatment of newly diagnosed patients with multiple myeloma.” (angol nyelven). Haematologica. 99 (2), 232-42. o. DOI:10.3324/haematol.2013.099358. PMID 24497560.
- ↑ Shimoni A, Hardan I, Ayuk F, Schilling G, Atanackovic D, Zeller W, Yerushalmi R, Zander AR, Kroger N, Nagler A. (2010. August). „Allogenic hematopoietic stem-cell transplantation with reduced-intensity conditioning in patients with refractory and recurrent multiple myeloma: long-term follow-up.” (angol nyelven). Cancer. 116 (15), 3621-30. o. DOI:10.1002/cncr.25228. PMID 20564132.
- ↑ San Miguel JF, Schlag R, Khuageva NK, et al. (2008. August). „Bortezomib plus melphalan and prednisone for initial treatment of multiple myeloma.” (angol nyelven). N Engl J Med. 359 (9), 906-17. o. DOI:10.1056/NEJMoa0801479. PMID 18753647.
- ↑ Gasparetto C, Gockerman JP, Diehl LF, et al. (2010. January). „"Short course" bortezomib plus melphalan and prednisone as induction prior to transplant or as frontline therapy for nontransplant candidates in patients with previously untreated multiple myeloma.” (angol nyelven). Biol Blood Marrow Transplant. 16 (1), 70-7. o. DOI:10.1016/j.bbmt.2009.08.017. PMID 19733251.
- ↑ a b c d Terpos E, Morgan G, Dimopoulos MA, et al. (2013. July). „International Myeloma Working Group recommendations for the treatment of multiple myeloma-related bone disease.” (angol nyelven). J Clin Oncol. 31 (18), 2347-57. o. DOI:10.1200/JCO.2012.47.7901. PMID 23690408.
- ↑ Bouza C, López-Cuadrado T, Cediel P, Saz-Parkinson Z, Amate JM. (2009. September). „Balloon kyphoplasty in malignant spinal fractures: a systematic review and meta-analysis.” (angol nyelven). BMC Palliat Care. 8, 12. o. DOI:10.1186/1472-684X-8-12. PMID 19740423.
- ↑ Balducci M, Chiesa S, Manfrida S, et al. (2011. February). „Impact of radiotherapy on pain relief and recalcification in plasma cell neoplasms: long-term experience.” (angol nyelven). Strahlenther Onkol. 187 (2), 114-9. o. DOI:10.1007/s00066-010-2155-9. PMID 21336712.
- ↑ a b Palumbo A, Mateos MV, Bringhen S, San Miguel JF. (2011. July). „Practical management of adverse events in multiple myeloma: can therapy be attenuated in older patients?” (angol nyelven). Blood Rev. 25 (4), 181-91. o. DOI:10.1016/j.blre.2011.03.005. PMID 21497966.
- ↑ a b Kumar SK, Rajkumar SV, Dispenzieri A, et al. (2008. March). „Improved survival in multiple myeloma and the impact of novel therapies.” (angol nyelven). Blood. 111 (5), 2516-20. o. DOI:10.1182/blood-2007-10-116129. PMID 17975015.
- ↑ Pulte D, Gondos A, Brenner H. (2011. October). „Improvement in survival of older adults with multiple myeloma: results of an updated period analysis of SEER data.” (angol nyelven). Oncologist. 16 (11), 1600-3. o. DOI:10.1634/theoncologist.2011-0229. PMID 21968047.
- ↑ Zink A, Rohrbach H, Szeimies U, Hagedorn HG, Haas CJ, Weyss C, Bachmeier B, Nerlich AG. (1999. September-October). „Malignant tumors in an ancient Egyptian population.” (angol nyelven). Anticancer Res. 19 (5B), 4273-7. o. PMID 10628386.
- ↑ Solly S. (1844). „Remarks on the pathology of mollities ossium; with cases.” (angol nyelven). Med Chir Trans. 27, 435-61. o. PMID 20895811.
- ↑ Henry Bence Jones: On the new substance occurring in the urine of a patient with mollities ossium. (angol nyelven). Royal Society of London, 1848. (Hozzáférés: 2014. július 12.)
- ↑ a b c d e Kyle RA, Steensma DP. (2011). „History of multiple myeloma.” (angol nyelven). Recent Results Cancer Res. 183, 3-23. o. DOI:10.1007/978-3-540-85772-3_1. PMID 21509678.
- ↑ Weber FP, Hutchison R, Macleod JJ. (1903). „A Case of Multiple Myeloma (Myelomatosis) with Bence-Jones Proteid in the Urine (Myelopathic Albumosuria of Bradshaw, Kahler's Disease), and a Summary of Published Cases of Bence-Jones Albumosuria: With a Report on the Chemical Pathology.” (angol nyelven). Med Chir Trans. 86, 395-470. o. PMID 20897004.
- ↑ Wright JH. (1900. April). „A case of multiple myeloma.” (angol nyelven). J Boston Soc Med Sci. 4 (8), 195-204. o. PMID 19971313.
- ↑ Longsworth LG, Shedlovsky T, Macinnes DA (1939. September). „Electrophoretic patterns of normal and pathological human blood serum and plasma.” (angol nyelven). J Exp Med. 70 (4), 399-413. o. PMID 19870918.
- ↑ Waldenstrom J. (1960-1961). „Studies on conditions associated with disturbed gamma globulin formation (gammopathies).” (angol nyelven). Harvey Lect. 56, 211-31. o. PMID 14004528.
- ↑ Matus RE, Leifer CE, MacEwen EG, Hurvitz AI. (1986. June). „Prognostic factors for multiple myeloma in the dog.” (angol nyelven). J Am Vet Med Assoc. 188 (11), 1288-92. o. PMID 3721983.
- ↑ Patel RT, Caceres A, French AF, McManus PM. (2005. December). „Multiple myeloma in 16 cats: a retrospective study.” (angol nyelven). Vet Clin Pathol. 34 (4), 341-52. o. PMID 16270258.
- ↑ Edwards DF, Parker JW, Wilkinson JE, Helman RG. title=Plasma cell myeloma in the horse. A case report and literature review. (1993. May-June). „{{{title}}}” (angol nyelven). J Vet Intern Med. 7 (3), 169-76. o. PMID 8331611.
- ↑ Gadó K, Silva S, Pálóczi K, Domján G, Falus A. (2001. March). „Mouse plasmacytoma: an experimental model of human multiple myeloma.” (angol nyelven). Haematologica. 86 (3), 227-36. o. PMID 11255268.
- ↑ Melixetian MB, Pavlenko MA, Beriozkina EV, Kovaleva ZV, Sorokina EA, Ignatova TN, Grinchuk TM. (2003. October). „Mouse myeloma cell line Sp2/0 multidrug-resistant variant as parental cell line for hybridoma construction.” (angol nyelven). Hybrid Hybridomics. 22 (5), 321-7. o. PMID 14678650.
| Az itt található információk kizárólag tájékoztató jellegűek, nem minősülnek orvosi szakvéleménynek, nem pótolják az orvosi kivizsgálást és kezelést. A cikk tartalmát a Wikipédia önkéntes szerkesztői alakítják ki, és bármikor módosulhat. |
