Nátrium-szelenid
| Nátrium-szelenid | |||
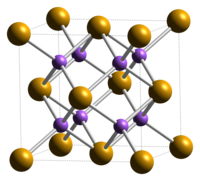
| |||
| IUPAC-név | nátrium-szelenid | ||
| Kémiai azonosítók | |||
|---|---|---|---|
| CAS-szám | 1313-85-5 | ||
| PubChem | 73973 | ||
| EINECS-szám | 215-212-0 | ||
| |||
| |||
| Kémiai és fizikai tulajdonságok | |||
| Kémiai képlet | Na2Se | ||
| Moláris tömeg | 124,95 g/mol | ||
| Megjelenés | fehér szilárd anyag | ||
| Sűrűség | 2,62 g cm−3[1] | ||
| Olvadáspont | >875 °C | ||
| Oldhatóság (vízben) | reakcióba lép a vízzel | ||
| Rokon vegyületek | |||
| Azonos kation | nátrium-szulfid nátrium-tellurid nátrium-oxid | ||
| Azonos anion | hidrogén-szelenid antimon-szelenid alumínium-szelenid | ||
| Rokon vegyületek | kálium-szelenid kálium-szelenát | ||
| Ha másként nem jelöljük, az adatok az anyag standardállapotára (100 kPa) és 25 °C-os hőmérsékletre vonatkoznak. | |||
A nátrium-szelenid nátriumból és szelénből álló ionvegyület, képlete Na2Se. Színtelen, szilárd anyag, melyet szelén és ammóniában oldott nátrium reakciójával állítanak elő.[2] Más alkálifém-kalkogenidekhez hasonlóan a nátrium-szelenid is könnyen reagál a vízzel, hidrolízise során nátrium-hidrogénszelenid (NaSeH) és hidroxidion keletkezik. A hidrolízis oka az, hogy a Se2- rendkívül erős bázis.
- Na2Se + H2O → NaHSe + NaOH
A nátrium-szelenid könnyen oxidálódik, ennek során poliszelenidek képződnek, amit az anyag elszíneződése jelez. Savakkal reagálva mérgező hidrogén-szelenid gáz keletkezik belőle.
- Na2Se + 2 HCl → H2Se + 2 NaCl
Alkil-halogenidekkel reagálva a megfelelő szelénorganikus vegyület keletkezik belőle.
- Na2Se + 2 RBr → R2Se + 2 NaBr
Szilíciumorganikus halogenidekkel a következő módon reagál:
- Na2Se + 2 Me3ECl → (Me3E)2Se + 2 NaCl (E = Si, Ge, Sn)
Veszélyei
szerkesztésA nátrium-szelenid tárolásánál vigyázni kell hogy ne érintkezzen vízzel és levegővel.
Fordítás
szerkesztésEz a szócikk részben vagy egészben a Sodium selenide című angol Wikipédia-szócikk ezen változatának fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.
Források
szerkesztés- ↑ szerk.: David R. Lide: CRC Handbook of Chemistry and Physics, 90th. ISBN 978-1-4200-9084-0
- ↑ Handbook of Preparative Inorganic Chemistry, 2nd Ed. Edited by G. Brauer, Academic Press, 1963, NY. Vol. 1. p. 421.