Szulfonsavak
Szulfonsavaknak azokat a szerves savakat nevezzük, melyek általános képlete R−S(=O)2−OH, ahol az R többnyire szénhidrogén oldalláncot jelöl.
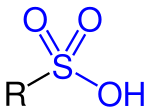
Szulfonsavak (R−S(=O)2−OH)
szerkesztésA szulfonsavak jellemzően sokkal erősebb savak, mint a megfelelő karbonsavak, egyedülálló sajátságuk, hogy szorosan képesek kötődni fehérjékhez és szénhidrátokhoz, ezért a legtöbb „mosható” színezék szulfonsav- vagy szulfonilcsoportot tartalmaz. Számos anyag előállításában katalizátorként és köztitermékként is használják. A szulfonsavakat és sóikat, a szulfonátokat rendkívül széles körben használják, például detergensekben, antibakteriális gyógyszerekben (szulfonamidok), anioncserélő gyantákban víztisztításhoz és színezékekben. A legegyszerűbb példa a metánszulfonsav (CH3SO2OH), mely gyakran használt szerves kémiai reagens. Fontos reagens a p-toluolszulfonsav is. A p-krezidinszulfonsavat élelmiszer-színezékek előállításához használják.
Szulfonsavészterek (R−S(=O)2−OR)
szerkesztésA szulfonsavészterek R−S(=O)2−OR általános képletű szerves vegyületek. A szulfonsavészterek – például a metil-triflát – jó távozó csoportok alifás nukleofil szubsztitúciós reakciókban.
Szulfonil-halogenidek (R−S(=O)2−X)
szerkesztésSzulfonil-halogenid csoportról akkor beszélünk, ha a szulfonil funkciós csoport egy halogénatomhoz kapcsolódik. Általános képletük R−S(=O)2−X, ahol X halogén.
Előállításuk
szerkesztésSzulfonsav a megfelelő szénhidrogén szulfonálásával állítható elő. Alkánok esetében a reakciót végezhetik kén-trioxiddal gázfázisban, vagy óleummal vagy klórszulfonsavval melegítve. Az aromás szénhidrogéneket tömény kénsavval, óleummal, esetleg klórszulfonsavval reagáltatva szulfonálják.[1]
Tulajdonságaik
szerkesztésAz alkánszulfonsavak többnyire nem vagy nehezen kristályosítható, szirupszerű vegyületek. A vízmentes aromás szulfonsavak erősen higroszkóposak. Magas olvadáspontú, víztartalmú kristályaik a vizet kémiailag kötött formában, hidroxónium-szulfát (R-SO−3 H3O+) alakjában tartalmazzák.
A szulfonsavak erős savak, vízben általában jól, szerves oldószerben nem oldódnak. A kénsavval szemben kalcium- és báriumsójuk is vízoldható.[1]
Lásd még
szerkesztés- Kénsav H2SO4
- Szulfónium S+, S+R3
Források
szerkesztés- ↑ a b Dr. Lempert Károly. Szerves kémia. Budapest: Műszaki Könyvkiadó (1976). ISBN 963-10-1191-7
Fordítás
szerkesztésEz a szócikk részben vagy egészben a Sulfonic acid című angol Wikipédia-szócikk ezen változatának fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.
Hivatkozások
szerkesztés- J.A. Titus, R. Haugland, S.O. Sharrow and D.M. Segal , Texas red, a hydrophilic, red-emitting fluorophore for use with fluorescein in dual parameter flow microfluorometric and fluorescence microscopic studies. J. Immunol. Methods 50 (1982), pp. 193–204. doi:10.1016/0022-1759(82)90225-3
- C. Lefevre, H.C. Kang, R.P. Haugland, N. Malekzadeh, S. Arttamangkul, and R. P. Haugland, Texas Red-X and Rhodamine Red-X, New Derivatives of Sulforhodamine 101 and Lissamine Rhodamine B with Improved Labeling and Fluorescence Properties, Bioconj Chem 1996, 7(4):482-9 doi:10.1021/bc960034p