Kénsav
| Kénsav | |||
| |||
| |||

| |||
| IUPAC-név | kénsav | ||
| Más nevek | vitriol, óleum, akkumulátorsav | ||
| Kémiai azonosítók | |||
|---|---|---|---|
| CAS-szám | 7664-93-9 | ||
| ChemSpider | 1086 | ||
| EINECS-szám | 231-639-5 | ||
| KEGG | D05963 | ||
| ChEBI | 26836 | ||
| RTECS szám | WS5600000 | ||
| |||
| |||
| InChIKey | QAOWNCQODCNURD-UHFFFAOYSA-N | ||
| UNII | O40UQP6WCF | ||
| ChEMBL | 572964 | ||
| Kémiai és fizikai tulajdonságok | |||
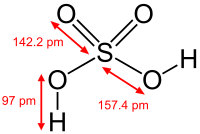
| Kémiai képlet | H2SO4 | ||
| Moláris tömeg | 98,079 g/mol | ||
| Megjelenés | tiszta, színtelen, szagtalan, olajszerű viszkózus folyadék | ||
| Sűrűség | 1,84 g/cm³ (folyadék) | ||
| Olvadáspont | 10 °C | ||
| Forráspont | 337 °C (300 °C felett lassan bomlik) | ||
| Oldhatóság (vízben) | korlátlanul elegyedik exoterm reakció | ||
| Savasság (pKa) | −3, 1,99 | ||
| Viszkozitás | 26,7 cP (20 °C) | ||
| Termokémia | |||
| Std. képződési entalpia ΔfH |
−814 kJ·mol−1[1] | ||
| Standard moláris entrópia S |
157 J·mol−1·K−1[1] | ||
| Hőkapacitás, C | 131 J/(mol·K) | ||
| Veszélyek | |||
| MSDS | ICSC 0362 | ||
| EU osztályozás | |||
| EU Index | 016-020-00-8 | ||
| NFPA 704 | |||
| R mondatok | R35 | ||
| S mondatok | (S1/2) S26 S30 S45 | ||
| Lobbanáspont | nem gyúlékony | ||
| LD50 | 2140 mg/kg (patkány, szájon át), LC50 = 25 mg/m³ (patkány, belélegezve) | ||
| Rokon vegyületek | |||
| Azonos anion | szulfátok | ||
| Rokon vegyületek | kénessav | ||
| Ha másként nem jelöljük, az adatok az anyag standardállapotára (100 kPa) és 25 °C-os hőmérsékletre vonatkoznak. | |||
A kénsav (H2SO4) színtelen, nagy sűrűségű folyadék, kétértékű, erős ásványi sav. Vízzel korlátlanul elegyedik. A kénsav a kémiai ipar egyik legfontosabb vegyülete, a legnagyobb mennyiségben előállított anyag. 2001-ben 165 millió tonnát gyártottak belőle. Legnagyobb arányban a műtrágyaipar hasznosítja, de szinte minden vegyipari ágazat alapanyagként használja.
A tömény kénsav erélyes vízelvonószer. Noha előállítható a 100%-os töménységű, úgynevezett füstölgő kénsav (más néven: óleum) is, a gyakorlatban 98,3%-nál töményebb savat a kén-trioxid (SO3) párolgása miatt nem használnak. Az ólomakkumulátorok celláit 33,5%-os kénsavval töltik fel.
A kénsav előfordul a természetben is, de csak kis mennyiségben, például egyes vulkáni vidékek folyóiban, vagy a kénvegyületek oxidációjaként kén-hidrogént tartalmazó barlangokban. Az iparban a kén-trioxid kénsavban való elnyeletésével, majd az így keletkezett óleum vízzel való hígításával állítják elő.
- H2SO4 + SO3 → H2S2O7
- H2S2O7 + H2O → 2 H2SO4
Fizikai tulajdonságai
szerkesztésA kénsav tiszta állapotban színtelen, olajszerű, magas forráspontú (338 °C) folyadék. Ezen tulajdonságai a kénsavmolekulák között fellépő hidrogénkötésen alapulnak. A tömény vagy koncentrált kénsav 96(±2) tömegszázalékos. Magas a viszkozitása és mesterségesen állítják elő, bár kis mennyiségben a természetben is előfordulhat főleg a vulkáni tevékenység következtében. A torjai Büdös-barlang kén-hidrogént is tartalmaz és az ottani lassú oxidáció eredményezheti a kénsav megjelenését.[2]
Kémiai tulajdonságai
szerkesztésA tömény kénsav erős vízelvonó (higroszkópos) tulajdonságú. A levegő nedvességtartalmát megköti, a szerves anyagokat, szénhidrátokat pedig elszenesíti: a hidrogént és az oxigént elvonja belőlük, és a szén marad vissza. Még a sók kristályvizét is képes elvonni.
A kénsav a hangyasavat is elbontja, szén-monoxid fejlődése közben. Így állítanak elő a laboratóriumokban is CO-ot.
Mivel a kénsav a legerősebb savak egyike (a tömény kénsav saverősségi határt jelent az egyszerűen erős savak és a szupersavak között), a gyengébb savak viselkedhetnek vele szemben bázisként (például a salétromsav). A forró, tömény kénsav olyan erős oxidálószer, hogy oxidálja a nemfémes elemek egy részét, többek között a szenet, a ként és a foszfort.
- H2SO4 + HNO3 → HSO−4 + H2NO+3
A kénsav maró hatású anyag, ezért a vele való munka elővigyázatot igényel. A kénsav hígítását emiatt úgy végzik, hogy az üvegbot állandó kevergetése közben lassan, vékony sugárban adják a vízhez. A kénsav vízben való oldódása erősen exoterm folyamat, ezért a nem megfelelően végzett hígításkor a víz felforrhat a fejlődő hő miatt, és szétfröccsentheti a kénsavat, ami súlyos sérüléseket okozhat.
A kénsav a vízzel korlátlanul elegyedik. Vízben való oldásakor két lépésben disszociál, először hidrogén-szulfátionra, majd szulfátionra. Mint minden kétértékű sav esetén, itt is az első disszociáció megy nagyobbrészt végbe, vagyis a kénsav erősebb sav, mint a hidrogén-szulfátion. Mindkettő a kénsav savmaradékionja. A kénsav és a hidrogén-szulfátion savállandói: pKs1=-3,00; pKs2=1,99
- H2SO4 + H2O → HSO−4 + H3O+
- H2SO4 + 2 H2O → SO2−4 + 2 H3O+
- HSO−4 + H2O → SO2−4 + H3O+
A kénsav vízben való oldódásának egyenlete:
- H2SO4 + H2O = H3O+ + HSO4-
- HSO4- + H2O = H3O+ + SO42-
Egyes reakciói:
- 2 NaCl + H2SO4 = 2 HCl + Na2SO4
- Ezzel a reakcióval sósavat és glaubersót lehet előállítani.
- NaCl + H2SO4 = HCl + NaHSO4
- Ezzel a reakcióval nátrium-biszulfátot és sósavat lehet előállítani. A reakcióban a nátrium-biszulfát és a nátrium-klorid hevítése további sósavat tehet szabaddá.
- NaCl + NaHSO4 = HCl + Na2SO4
- Fe + H2SO4 = FeSO4 + H2
Szulfátok
szerkesztésA hidrogén-szulfátok és a szulfátok a kénsav sói. A hidrogén-szulfátok vízzel hidrolizálnak, átadják a protonjukat, ezért ezeknek vizes oldata savas kémhatású.
- Na+ (aq) + HSO−4 (aq) → Na+ + SO2−4 + H3O+
Vagyis az oldatban az oxóniumionok kerülnek túlsúlyba a hidroxidionokkal szemben.
Az alumínium-szulfát, az alumínium-kálium-szulfát, az ammónium-szulfát, a réz-szulfát és a vas(III)-szulfát vizes oldata is savas kémhatású.
A híg kénsav reakcióba lép a vassal, a magnéziummal, és az alumíniummal. Nem reagál a rézzel és az ólommal. Vassal való reakciójának egyenlete:
- Fe + H2SO4 = H2 + FeSO4 vas-szulfát
A forró tömény kénsav a rezet is feloldja, két lépésben, mivel előbb oxidálja:
- Cu + cc. H2SO4 → CuO + H2O + SO2
- CuO + H2SO4 → CuSO4 + H2O
Hasonlóan viszi oldatba a forró tömény kénsav a higanyt és az ezüstöt is.
A tömény kénsav oxidálja a vasat, tömör vas-oxid réteg alakul ki. Ezért lehet a kénsavat vastartályban szállítani.
Az ólmot már a híg kénsav is passziválja, az ólom felületén oldhatatlan ólom-szulfát keletkezik.
A tömény kénsav lúgokkal, például nátrium-hidroxid oldattal közömbösíthető. Ekkor nátrium-szulfát (glaubersó) és víz keletkezik.
- H2SO4 + 2 NaOH → Na2SO4 + 2 H2O
- H2SO4 + Ca(OH)2 → CaSO4 + 2 H2O
Kénsavészterek
szerkesztésA kénsavészterek a kénsav és különböző alkoholok vegyületei. Nagy gyakorlati jelentőségük van, mosószerként használatosak. Előnyük a szappanokkal szemben, hogy kemény vízben vagy savas közegben is kifejtik hatásukat. Gyártásuk során a kénsavnak csak egyik felét észteresítik el, a másik savas csoportot sóvá alakítják.
Kénsavgyártás
szerkesztésA kénsavgyártás alapanyaga többnyire elemi kén, illetve a fém-szulfidok. A ként elégetve vagy a szulfidokat pörkölve kén-dioxid keletkezik.
- S + O2 → SO2
- 2 ZnS + 3 O2 → 2 ZnO + 2 SO2
- HgS + O2 → Hg + SO2
A kén-dioxidot tovább oxidálják, ilyenkor kén-trioxid keletkezik:
- 2 SO2 + O2 ⇌ 2 SO3
Az exoterm reakció egyensúlyra vezet, ezért célszerű alacsony hőmérsékleten (400-500 °C) végezni, azonban homogén fázisban a reakció sebessége nagyon kicsi. A reakciósebességet vanádium-pentoxid katalizátor alkalmazásával növelik. A kén-trioxidot gyakorlati okok miatt nem vízben, hanem tömény kénsavban nyeletik el, majd az így keletkező dikénsavat (pirokénsav, óleum) vízben a megfelelő töménységűre hígítják.
Felhasználása
szerkesztésA kénsav vegyipari alapanyag, emellett a laboratóriumban is gyakran használják. A kénsavat műtrágyagyártásra, mosószergyártásra, festékgyártásra, gyógyszergyártásra és robbanószerek gyártására is használják. Emellett kénsav az ólomakkumulátorok töltőfolyadéka.
Jegyzetek
szerkesztés- ↑ a b Zumdahl, Steven S.. Chemical Principles 6th Ed.. Houghton Mifflin Company, A23. o. (2009). ISBN 0-618-94690-X
- ↑ Kén oxidjai és oxosavai (magyar nyelven). ttko.hu. (Hozzáférés: 2023. augusztus 9.)
