Y-kromoszomális nemmeghatározó fehérje
Az Y-kromoszomális nemmeghatározó fehérje (SRY) DNS-kötő protein (más néven génszabályozó fehérje/transzkripciós faktor), melyet az SRY gén kódol, és a hímivar meghatározója elevenszülőkben.[1] Az SRY intronmentes nemmeghatározó gén az Y kromoszómán.[2] Mutációi számos ivari fejlődési rendellenességet okoz, melyek fenotípusra és genotípusra gyakorolt hatásai eltérnek.
| Y-kromoszomális nemmeghatározó fehérje | |
 | |
| Azonosítók | |
| Jel | SRY |
| Entrez | 6736 |
| OMIM | 480000 |
| UniProt | Q05066 |
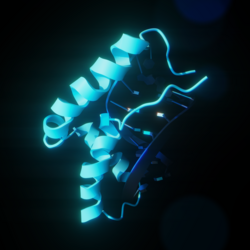
| PDB | 1HRY |
| Egyéb adatok | |
| Lokusz | Y krom. p11.2 |
Az SRY a DNS-kötő fehérjék SOX (SRY-szerű box) családjába tartozik. A SF-1 fehérjével együtt az SRY transzkripciós faktorként működik, mely más transzkripciós faktorokat erősít, például a SOX9-et.[3] Expressziója az elsődleges ivari szöveteket hozza létre, ezek később ondócsatornákká alakulnak. Ezek a még nem differenciált gonád központi részei, melyet herévé alakítanak. A már indukált Leydig-sejtek tesztoszteront kezdenek elválasztani, a Sertoli-sejtek anti-Müller hormont.[4] Az SRY gén hatása a magzat kialakulása után 6-8 héttel jelentkezik, mely a női anatómiai szerkezeti növekedést akadályozza. Ezenkívül a másodlagos ivari jellegek kialakulásában is fontos.
Evolúciója és szabályzása
szerkesztésEvolúció
szerkesztésAz SRY feltehetően az X-kromoszóma SOX3 génjének duplikációjával alakult ki.[5][6] Ez a kloákások és az elevenszülő emlősök elválása után alakult ki. A kloákásokban nincs SRY, egyes ivari kromoszómáik a madarakéival homológok.[7] Az SRY gyorsan fejlődő gén, szabályzását nehéz tanulmányozni, mivel az állatok közt nem állandó az ivarmeghatározás.[8] Még a nemmeghatározáshoz az SRY gént használó elevenszülő emlősökben is eltér az SRY hatása fajonként.[6] A génszekvencia is változik – míg a magja, a nagy mobilitású csoport (HMG box) fajok közt állandó, a gén többi része nem.[6] Az SRY egyike a humán Y kromoszómán lévő 4 génnek, mely az eredeti Y kromoszómában megvolt.[9] A többi gén az eredeti Y kromoszómával egyesült autoszóma révén jelent meg.[9]
Szabályzás
szerkesztésAz SRY-nak nincs sok közös része más modellszervezetek ivarmeghatározó génjeivel, így az egereket használják fő modellszervezetnek a tanulmányozásához. Szabályzásának megértését nehezíti, hogy a szekvenciahasonlóság még emlősfajok közt is kicsi. Az egyetlen hasonló csoport egerekben és más emlősökben a DNS-kötésért felelős HMG box. Ennek mutációi ivarfordulást okoznak.[10] A kis hasonlóság miatt az SRY promotere, szabályzóelemei és szabályzása se jól ismertek. Hasonló emlőscsoportokban az első 400-600 bázispárral (bp) a startkodon előtt található hasonló csoport. A humán SRY-promoter in vitro tanulmányai szerint egy legalább 310 bp-ral a startkodon előtti rsz szükséges az SRY-promoter működéséhez. Ezenkívül 3 transzkripciós faktor, a szteroidogén faktor 1 (SF1), a specificitásprotein 1 (Sp1) és a Wilms-tumorprotein 1 (WT1) humán promoterhez való kötődése befolyásolja az SRY expresszióját.[10]
A promoternek két szabályzóhelyként működő Sp1-kötő helye van (-150 és -13). Az Sp1 GC-gazdag konszenzusszakaszokat kötő transzkripciós faktor, az SRY-kötőhelyek mutációja 90%-os géntranszkripció-csökkenést okoz. Az SF1 tanulmányai kevésbé egyértelmű eredményeket adtak. Az SF1 mutációija ivarfordulást, deléciója nem teljes ivarszervfejlődést okoz. Azonban nem ismert az SF1 közvetlen kölcsönhatásának módja az SR1 promoterrel.[11] A promoternek van két WT1-kötő helye is a startkodon előtt 78 és 87 bp-ral. A WT1 egy 4 C-terminális cinkujjal és egy N-terminális Pro/Glu-gazdag résszel rendelkező transzkripciós faktor, és elsősorban aktivátorként működik. A cinkujjak mutációj vagy a WT1 inaktivációja kisebb férfinemiszerv-méretet okoz. A gén deléciója teljes ivarfordulást okoz. Nem ismert a WT1 SRY-erősítő működésének módja, de egyes kutatások szerint segíti az üzenetfeldolgozás stabilizálását.[11] Azonban e hipotézis kérdéseket vet fel, mivel a WT1 felel a férfi ivari fejlődést gátló DAX1 (dózisszenzitív ivarfordulás, adrenalishypoplasia-kritikus régió, X kromoszóma, 1. gén) transzkripciójáért is. A DAX1 további másolata egerekben ivarfordulást okoz. Nem ismert a DAX1 működése, és számos eltérő útvonalat javasoltak, például az SRY transzkripciós destabilizációját és az RNS-kötést. A DAX1 az SF1 működésével való interferenciával akadályozza a férfi ivar fejlődését, korepresszorokkal az SRY transzkripcióját.[10]
Ezenkívül a GATA-kötő protein 4 (GATA4) és a FOG2 az SRY-t annak promoterével való asszociációjával aktiválja. Ezek SRY-transzkripciót szabályzó módja nem ismert, de a FOG2- és GATA4-mutánsok SRY-transzkripciója jelentősen kisebb.[12] A FOG-oknak DNS-kötő cinkujjmotívumaik vannak, de nem ismert a FOG2 és az SRY közti kölcsönhatás. Tanulmányok szerint a FOG2 és a GATA4 aktivációokozó nukleoszóma-újramodellező fehérjékkel asszociálnak.[13]
Működés
szerkesztésGestatio során az urogenitalis üregnél lévő elsődleges gonádsejtek bipotensek – átalakulhatnak férfi (Sertoli- és Leydig-) vagy női (follikulusz- és theca-) sejtekké is. Az SRY a heredifferenciációt indítja el férfispecifikus transzkripciós faktorok átalakításával, ezek lehetővé teszik e bipotens sejtek differenciációját és proliferációját. Az SRY ezt a hozzá hasonló DNS-kötő hellyel rendelkező SOX9 erősítésével éri el. A SOX9 a fibroblaszt-növekedési faktor 9 (Fgf9) erősítéséhez vezet, mely tovább erősíti a SOX9-et. A megfelelő SOX9-szintek elérése után a bipotens sejtek Sertoli-sejtekké alakulnak, az SRY-t expresszálók pedig tovább proliferálódnak, létrehozva az elsődleges herét. Ez alkotja az alapvető eseménysorozatot, de az ivari differenciációt több tényező is befolyásolja.
Hatása a sejtmagban
szerkesztésAz SRY fehérje 3 fő régióból áll. A központi tartalmazza a HMG domént, mely magi lokalizációs szekvenciákat tartalmaz, és DNS-kötő fehérjeként működik. A C-terminális doménben nincs állandó szekvencia, az N-terminális foszforilálható, elősegítve a DNS-kötést.[11] A folyamat az SRY magi lokalizációjával indul a magi lokalizációs szignálrégiók acetilezésével, mely lehetővé teszi az importin β és a kalmodulin SRY-hoz való kötését, megkönnyítve a magba jutását. Ezután az SRY és az SF1 komplexet alkotnak, és a TESCO-hoz (herespecifikus Sox9-mag-erősítő) kötődnek, mely a Sox9 gén Sertoli-sejt-prekurzorokban lévő herespecifikus erősítője, mely a Sox9 gén transzkripciójának kezdeti helye előtt található.[3] Pontosabban az SRY HMG régiója kapcsolódik a DNS-célszekvencia kis üregéhez, a DNS hajlását és lazulását okozva. E DNS-alakzat létrejötte könnyíti a Sox9 gén transzkripcióját.[11] A Sertoli-sejtek magjában a SOX9 közvetlenül célozza az Amh és a prosztaglandin-D-szintáz (Ptgds) génjeit. Az Amh-promoterhez közeli erősítőhöz kötődő Sox9 az Amh-, a Ptgds-génhez kapcsolódó a prosztaglandin D2 (PGD2)-szintézist teszi lehetővé. A SOX9 magba való visszatérését könnyítik a PGD2 által vezérelt auto- vagy parakrin jelzések.[14] A SOX9 ezután pozitív visszacsatolási ciklust indít el, melyben a SOX9 a saját transzkripciós faktoraként működik, nagy mennyiségű SOX9-szintézist okozva.[11]
A SOX9 és a heredifferenciáció
szerkesztésAz SF-1 fehérje önmagában a SOX9 génnek kis mértékű transzkripcióját okozza XX és XY bipotens gonádsejtekben egyaránt. Azonban az SRY-SF1 komplex TESCO-hoz való kapcsolódása a SOX9-en nagymértékű génerősítést csak az XY gonádban okoz, míg az XX gonádban csekély marad a transzkripció. Ezt részben maga a SOX9 okozza pozitív visszacsatolással – ez az SRY-hoz hasonlóan komplexet alkot az SF1-gyel, és a TESCO-hoz kapcsolódik, az XY-gonádban további SOX9-expressziót okozva. További 2 fehérje, az FGF9 (fibroblaszt-növekedési faktor 9) és a PGD2 (prosztaglandin D2) ezt fenntartják. Bár ezek útvonalai nem teljesen ismertek, ezek fontosak a herékhez fontos folyamatos SOX9-expresszióhoz.[3]
A SOX9 és az SRY feltehetően fontosak a gonádok támasztósejt-prekurzorainak Sertoli-sejtekké alakulásában, amely a herefejlődés kezdete. A kezdeti Sertoli-sejtek a gonád közepén feltehetően a fejlődő gonádon végighaladó FGF9-hullám kezdetei, mely további Sertoli-sejt-differenciációt okoz a SOX9 erősítése révén.[15] A SOX9 és az SRY feltehetően ezenkívül a herefejlődés számos késpbbi lépésében (például a Leydig-sejtek kialakulásában, az elsődleges ivari szövetek kialakulásában és a herespecifikus erek kialakulásában) is fontosak, de ennek mechanizmusai ismeretlenek.[16] Ismert azonban, hogy a SOX9 PGD2 jelenlétében közvetlenül hat az anti-Müller-hormont kódoló Amh-ra, és képes XX-gonádokban is herék előállítását indukálni, ami a herefejlődésben való fontosságát mutatja.[15]
Az SRY-rendellenességek hatása a nemre
szerkesztésAz embriók gonádjai azonosak genetikai nemtől függetlenül, a fejlődés egy pontjáig, amikor az Y-kromoszomális nemmeghatározó fehérje férfi nemi szervek fejlődését okozza. A férfi kariotípus XY, a női XX. Vannak kivételek, ahol az SRY fontos szerepet játszik. A Klinefelter-szindróma egy normál Y és két X kromoszóma jelenlétét jelenti, XXY kariotípust adva. Ezen emberek férfinak tekinthetők.[17] Az atipikus genetikai rekombináció egy hímivarsejt fejlődésekor a fenotípusnak nem megfelelő kariotípusokat eredményezhet.
Általában a meiózis során bekövetkező átkereszteződéskor az SRY gén az Y kromoszómán marad. Ha az SRY gén az X kromoszómára kerül, nem történik herefejlődés. Ez a Swyer-szindróma, mely XY kariotípus melletti női fenotípust jelent. Erre normálisan kialakult méhek és petevezetékek jellemzőek, de a gonádok nem működnek. A Swyer-szindrómásokra így általában nőként tekintenek, és eszerint nevelik.[18] XX-férfi-szindróma akkor történik, ha női kromoszómák vannak jelen, de ezek egyikén megtalálható transzlokáció miatt az SRY. Ez női kariotípus melletti férfi fenotípust jelent,[19] és késői pubertást, terméketlenséget és a másik nemre jellemző növekedési jellemzőket okoz. Az XX-férfi-szindrómában érintettek esetén mellek, a Swyer-szindrómában érintettek esetén arcszőrzet alakulhat ki.[18][20]
| Rendellenesség | Jellemzők |
|---|---|
| Klinefelter-szindróma |
|
| Swyer-szindróma |
|
| XX-férfi-szindróma |
|
Míg az SRY jelenléte vagy hiánya általában meghatározza, hogy történik-e herefejlődés, feltehetően vannak más tényezők is, melyek befolyásolják az SRY működését.[21] Így előfordulhatnak az SRY génnel rendelkező nőként fejlődő emberek vagy a gén hiányossága vagy mutációja, vagy az egyik közreműködő tényező hiányossága miatt.[22] Ez történhet XY, XXY vagy SRY-pozitív XX kariotípus esetén is.
Ezenkívül további SRY-n alapuló nemmeghatározó rendszerek azok, melyek az SRY jelenlétén vagy hiányán alapulónál későbbiek. Normál rendszerben, ha az SRY jelen van (XY), az a medullát a gonádok herékké fejlesztésében aktiválja. Ekkor tesztoszteron keletkezik, elindítva a többi férfi nemi jellemzők fejlődését. Ha nincs jelen SRY (XX), az Y kromoszóma hiánya miatt nincs jelen SRY. Az SRY hiánya lehetővé teszi az embrió gonádjainak kérge számára a petefészkekké fejlődést, melyek ösztrogént állítanak elő, a többi női nemi jellemző kialakulását okozva.[23]
Szerepe más betegségekben
szerkesztésAz SRY képes kölcsönhatásba lépni az androgénreceptorral, és az XY kariotípusú, működő SRY génnel rendelkező emberek is lehetnek nők androgéninszenzitivitás-szindróma (AIS) miatt.[24] Az AIS-es emberek nem tudnak megfelelően reagálni az androgénekre az androgénreceptor-génben való hiba miatt, és ez lehet teljes vagy részleges.[25] Az SRY-t összekapcsolták azzal, hogy a férfiakban nagyobb valószínűséggel fordul elő a nőknél dopaminnal összefüggő betegség, például skizofrénia vagy Parkinson-kór. Az SRY egy mozgást és koordinációt irányító neurotranszmitter, a dopamin koncentrációját irányító fehérjét kódol.[26] Egy SRY-szerű kódolt transzkripciós faktor, a SOX10 mutációja összefügg a domináns nagyvastagbelűséggel egerekben.[27] Ezt az egérmodellt használták az SRY és a Hirschsprung-kór (humán congenitalis nagyvastagbelűség) közti összefüggés vizsgálatára is.[27] Összefüggés van ezenkívül a SOX9 és a kampomél diszplázia (CD) közt is.[28] E misszenz mutáció hiányos chondrogenezist okoz, és váz-CD-ként jelentkezik.[29] A CD-vel diagnosztizált 46,XY kariotípusúak kétharmadában különböző mértékű ivarfordulás található.[28]
Sportvizsgálati használata
szerkesztésAz egyik legvitatottabb használata e felfedezésének az olimpiákon nemellenőrzésre való használata, melyet 1992-ben vezetett be a Nemzetközi Olimpiai Bizottság. Az SRY génnel rendelkező sportolók nem vehettek részt nőként, de minden sportoló, ahol kimutatták az 1996. évi olimpián, hamis pozitívnak bizonyultak, így nem zárták ki. A 3387-ből 8 női sportolónál mutatták ki az SRY gént. További genetikai vizsgálat után azonban ezeket nőként azonosították, így versenyezhettek. E sportolóknál részleges vagy teljes androgéninszenzitivitást mutattak ki az SRY gén ellenére, női fenotípust okozva.[30] Az 1990-es évek végén számos kapcsolódó amerikai egyesült államokbeli bizottság, például az American Medical Association javasolta a nemellenőrzés megszüntetését annak bizonytalanságára és hatástalanságára hivatkozva.[31] A kromoszomális vizsgálatot 2000-ben megszüntették,[31][32][33] ezt később a hormonszintalapú tesztelés váltotta fel.[34]
Jelenlegi kutatások
szerkesztésAz elmúlt néhány évtizedben a nemmeghatározás, az SRY gén és a fehérjéje irányában végzett kutatás ellenére még 2023-ban is folynak kutatások e területeken. Vannak a nemmeghatározásban még azonosítatlan faktorok, és a humán ivarfordulási esetekben előforduló kromoszomális változások még ismeretlenek. További kutatásokat végeznek további nemmeghatározó gének keresésére például a genitalis bemélyedés mikrocsoport-analízisével különböző fejlődési szakaszokban, ivarfordulásos fenotípusú egerek mutagenezis-elemzésével és a transzkripciós faktorok által befolyásolt gének azonosítása terén kromatin-immunkicsapással.[11]
Jegyzetek
szerkesztés- ↑ Berta P, Hawkins JR, Sinclair AH, Taylor A, Griffiths BL, Goodfellow PN, Fellous M (1990. november 1.). „Genetic evidence equating SRY and the testis-determining factor”. Nature 348 (6300), 448–50. o. DOI:10.1038/348448A0. PMID 2247149.
- ↑ Wallis MC, Waters PD, Graves JA (2008. október 1.). „Sex determination in mammals--before and after the evolution of SRY”. Cellular and Molecular Life Sciences 65 (20), 3182–95. o. DOI:10.1007/s00018-008-8109-z. PMID 18581056.
- ↑ a b c Kashimada K, Koopman P (2010. december 1.). „Sry: the master switch in mammalian sex determination”. Development 137 (23), 3921–30. o. DOI:10.1242/dev.048983. PMID 21062860.
- ↑ Mittwoch U (1988. október 1.). „The race to be male”. New Scientist 120 (1635), 38–42. o.
- ↑ Katoh K, Miyata T (1999. december 1.). „A heuristic approach of maximum likelihood method for inferring phylogenetic tree and an application to the mammalian SOX-3 origin of the testis-determining gene SRY”. FEBS Letters 463 (1–2), 129–32. o. DOI:10.1016/S0014-5793(99)01621-X. PMID 10601652.
- ↑ a b c Bakloushinskaya, I Y (2009). „Evolution of sex determination in mammals”. Biology Bulletin 36 (2), 167–174. o. DOI:10.1134/S1062359009020095.
- ↑ Veyrunes F, Waters PD, Miethke P, Rens W, McMillan D, Alsop AE, Grützner F, Deakin JE, Whittington CM, Schatzkamer K, Kremitzki CL, Graves T, Ferguson-Smith MA, Warren W, Marshall Graves JA (2008. június 1.). „Bird-like sex chromosomes of platypus imply recent origin of mammal sex chromosomes”. Genome Research 18 (6), 965–73. o. DOI:10.1101/gr.7101908. PMID 18463302. PMC 2413164.
- ↑ Bowles J, Schepers G, Koopman P (2000. november 1.). „Phylogeny of the SOX family of developmental transcription factors based on sequence and structural indicators”. Developmental Biology 227 (2), 239–55. o. DOI:10.1006/dbio.2000.9883. PMID 11071752.
- ↑ a b Graves JA (2015. december 1.). „Weird mammals provide insights into the evolution of mammalian sex chromosomes and dosage compensation”. Journal of Genetics 94 (4), 567–74. o. DOI:10.1007/s12041-015-0572-3. PMID 26690510.
- ↑ a b c Ely D, Underwood A, Dunphy G, Boehme S, Turner M, Milsted A (2010. november 1.). „Review of the Y chromosome, Sry and hypertension”. Steroids 75 (11), 747–53. o. DOI:10.1016/j.steroids.2009.10.015. PMID 19914267. PMC 2891862.
- ↑ a b c d e f Harley VR, Clarkson MJ, Argentaro A (2003. augusztus 1.). „The molecular action and regulation of the testis-determining factors, SRY (sex-determining region on the Y chromosome) and SOX9 [SRY-related high-mobility group (HMG) box 9]”. Endocrine Reviews 24 (4), 466–87. o. DOI:10.1210/er.2002-0025. PMID 12920151.
- ↑ Knower KC, Kelly S, Harley VR (2003). „Turning on the male--SRY, SOX9 and sex determination in mammals”. Cytogenetic and Genome Research 101 (3–4), 185–98. o. [2017. augusztus 9-i dátummal az eredetiből archiválva]. DOI:10.1159/000074336. PMID 14684982.
- ↑ Zaytouni T, Efimenko EE, Tevosian SG (2011. december 8.). „GATA transcription factors in the developing reproductive system”. Advances in Genetics 76, 93–134. o. DOI:10.1016/B978-0-12-386481-9.00004-3. PMID 22099693.
- ↑ Sekido R, Lovell-Badge R (2009. január 1.). „Sex determination and SRY: down to a wink and a nudge?”. Trends in Genetics 25 (1), 19–29. o. DOI:10.1016/j.tig.2008.10.008. PMID 19027189.
- ↑ a b McClelland K, Bowles J, Koopman P (2012. január 1.). „Male sex determination: insights into molecular mechanisms”. Asian Journal of Andrology 14 (1), 164–71. o. DOI:10.1038/aja.2011.169. PMID 22179516. PMC 3735148.
- ↑ Sekido R, Lovell-Badge R (2013). „Genetic control of testis development”. Sexual Development 7 (1–3), 21–32. o. DOI:10.1159/000342221. PMID 22964823.
- ↑ Klinefelter syndrome (angol nyelven). Genetics Home Reference. National Library of Medicine, National Institutes of Health, U.S. Department of Health and Human Services. (Hozzáférés: 2020. március 3.)
- ↑ a b Swyer syndrome (angol nyelven). Genetics Home Reference. National Library of Medicine, National Institutes of Health, U.S. Department of Health and Human Services. (Hozzáférés: 2020. március 3.)
- ↑ XX Male Syndrome. encyclopedia.com . (Hozzáférés: 2020. március 3.)
- ↑ 46,XX testicular disorder of sex development (angol nyelven). Genetics Home Reference. National Library of Medicine, National Institutes of Health, U.S. Department of Health and Human Services. (Hozzáférés: 2020. március 3.)
- ↑ Polanco JC, Koopman P (2007. február 1.). „Sry and the hesitant beginnings of male development”. Developmental Biology 302 (1), 13–24. o. DOI:10.1016/j.ydbio.2006.08.049. PMID 16996051.
- ↑ Biason-Lauber A, Konrad D, Meyer M, DeBeaufort C, Schoenle EJ (2009. május 1.). „Ovaries and female phenotype in a girl with 46,XY karyotype and mutations in the CBX2 gene”. American Journal of Human Genetics 84 (5), 658–63. o. DOI:10.1016/j.ajhg.2009.03.016. PMID 19361780. PMC 2680992.
- ↑ Marieb EN, Hoehn K. Human Anatomy & Physiology, Eleventh (2018). ISBN 978-0-13-458099-9. OCLC 1004376412
- ↑ Yuan X, Lu ML, Li T, Balk SP (2001. december 1.). „SRY interacts with and negatively regulates androgen receptor transcriptional activity”. The Journal of Biological Chemistry 276 (49), 46647–54. o. DOI:10.1074/jbc.M108404200. PMID 11585838.
- ↑ Lister Hill National Center for Biomedical Communications: Androgen insensitivity syndrome. Genetics Home Reference. U.S. National Library of Medicine, 2008
- ↑ Dewing P, Chiang CW, Sinchak K, Sim H, Fernagut PO, Kelly S, Chesselet MF, Micevych PE, Albrecht KH, Harley VR, Vilain E (2006. február 1.). „Direct regulation of adult brain function by the male-specific factor SRY”. Current Biology 16 (4), 415–20. o. DOI:10.1016/j.cub.2006.01.017. PMID 16488877.
- ↑ a b Herbarth B, Pingault V, Bondurand N, Kuhlbrodt K, Hermans-Borgmeyer I, Puliti A, Wegner M (1998). „Mutation of the Sry-related Sox10 gene in Dominant megacolon, a mouse model for human Hirschsprung disease”. Proceedings of the National Academy of Sciences 95 (9), 5161–5165. o. DOI:10.1073/pnas.95.9.5161. PMID 9560246. PMC 20231.
- ↑ a b Pritchett J, Athwal V, Roberts N, Hanley NA, Hanley KP (2011). „Understanding the role of SOX9 in acquired diseases: lessons from development”. Trends in Molecular Medicine 17 (3), 166–174. o. DOI:10.1016/j.molmed.2010.12.001. PMID 21237710.
- ↑ OMIM Entry – # 114290 – CAMPOMELIC DYSPLASIA. omim.org . (Hozzáférés: 2020. február 29.)
- ↑ Olympic Gender Testing
- ↑ a b Facius GM: The Major Medical Blunder of the 20th Century. Gender Testing. facius-homepage.dk, 2004. augusztus 1. [2010. január 26-i dátummal az eredetiből archiválva]. (Hozzáférés: 2011. június 12.)
- ↑ Elsas LJ, Ljungqvist A, Ferguson-Smith MA, Simpson JL, Genel M, Carlson AS, Ferris E, de la Chapelle A, Ehrhardt AA (2000). „Gender verification of female athletes”. Genetics in Medicine 2 (4), 249–54. o. DOI:10.1097/00125817-200007000-00008. PMID 11252710.
- ↑ Dickinson BD, Genel M, Robinowitz CB, Turner PL, Woods GL (2002. október 1.). „Gender verification of female Olympic athletes”. Medicine and Science in Sports and Exercise 34 (10), 1539–42; discussion 1543. o. DOI:10.1097/00005768-200210000-00001. PMID 12370551.
- ↑ IOC Regulations on Female Hyperandrogenism. International Olympic Committee, 2012. június 22. [2012. augusztus 13-i dátummal az PDFfiles/Medical_commission/2012-06-22-IOC-Regulations-on-Female-Hyperandrogenism-eng.pdf eredetiből archiválva]. (Hozzáférés: 2012. augusztus 9.)
Fordítás
szerkesztésEz a szócikk részben vagy egészben a Sex-determining region Y protein című angol Wikipédia-szócikk ezen változatának fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.
Források
szerkesztés- Haqq CM, King CY, Ukiyama E, Falsafi S, Haqq TN, Donahoe PK, Weiss MA (1994. december 1.). „Molecular basis of mammalian sexual determination: activation of Müllerian inhibiting substance gene expression by SRY”. Science 266 (5190), 1494–500. o. DOI:10.1126/science.7985018. PMID 7985018.
- Goodfellow PN, Lovell-Badge R (1993). „SRY and sex determination in mammals”. Annual Review of Genetics 27 (1), 71–92. o. DOI:10.1146/annurev.ge.27.120193.000443. PMID 8122913.
- Hawkins JR (1993). „Mutational analysis of SRY in XY females”. Human Mutation 2 (5), 347–50. o. DOI:10.1002/humu.1380020504. PMID 8257986.
- Harley VR. The Molecular Action of Testis‐Determining Factors SRY and SOX9, The Genetics and Biology of Sex Determination, Novartis Foundation Symposia, 57–66; discussion 66–7, 79–85, 253–7. o.. DOI: 10.1002/0470868732.ch6 (2002). ISBN 978-0-470-86873-7
- Jordan BK, Vilain E. SRY and the Genetics of Sex Determination, Pediatric Gender Assignment, Advances in Experimental Medicine and Biology, 1–13; discussion 13–4. o.. DOI: 10.1007/978-1-4615-0621-8_1 (2002). ISBN 978-1-4613-5162-7
- Oh HJ, Lau YF (2006. március 1.). „KRAB: a partner for SRY action on chromatin”. Molecular and Cellular Endocrinology 247 (1–2), 47–52. o. DOI:10.1016/j.mce.2005.12.011. PMID 16414182.
- Polanco JC, Koopman P (2007. február 1.). „Sry and the hesitant beginnings of male development”. Developmental Biology 302 (1), 13–24. o. DOI:10.1016/j.ydbio.2006.08.049. PMID 16996051.
- Hawkins JR, Taylor A, Berta P, Levilliers J, Van der Auwera B, Goodfellow PN (1992. február 1.). „Mutational analysis of SRY: nonsense and missense mutations in XY sex reversal”. Human Genetics 88 (4), 471–4. o. DOI:10.1007/BF00215684. PMID 1339396.
- Hawkins JR, Taylor A, Goodfellow PN, Migeon CJ, Smith KD, Berkovitz GD (1992. november 1.). „Evidence for increased prevalence of SRY mutations in XY females with complete rather than partial gonadal dysgenesis”. American Journal of Human Genetics 51 (5), 979–84. o. PMID 1415266. PMC 1682856.
- Ferrari S, Harley VR, Pontiggia A, Goodfellow PN, Lovell-Badge R, Bianchi ME (1992. december 1.). „SRY, like HMG1, recognizes sharp angles in DNA”. The EMBO Journal 11 (12), 4497–506. o. DOI:10.1002/j.1460-2075.1992.tb05551.x. PMID 1425584. PMC 557025.
- Jäger RJ, Harley VR, Pfeiffer RA, Goodfellow PN, Scherer G (1992. december 1.). „A familial mutation in the testis-determining gene SRY shared by both sexes”. Human Genetics 90 (4), 350–5. o. DOI:10.1007/BF00220457. PMID 1483689.
- Vilain E, McElreavey K, Jaubert F, Raymond JP, Richaud F, Fellous M (1992. május 1.). „Familial case with sequence variant in the testis-determining region associated with two sex phenotypes”. American Journal of Human Genetics 50 (5), 1008–11. o. PMID 1570829. PMC 1682588.
- Müller J, Schwartz M, Skakkebaek NE (1992. július 1.). „Analysis of the sex-determining region of the Y chromosome (SRY) in sex reversed patients: point-mutation in SRY causing sex-reversion in a 46,XY female”. The Journal of Clinical Endocrinology and Metabolism 75 (1), 331–3. o. DOI:10.1210/jcem.75.1.1619028. PMID 1619028.
- McElreavey KD, Vilain E, Boucekkine C, Vidaud M, Jaubert F, Richaud F, Fellous M (1992. július 1.). „XY sex reversal associated with a nonsense mutation in SRY”. Genomics 13 (3), 838–40. o. DOI:10.1016/0888-7543(92)90164-N. PMID 1639410.
- Sinclair AH, Berta P, Palmer MS, Hawkins JR, Griffiths BL, Smith MJ, Foster JW, Frischauf AM, Lovell-Badge R, Goodfellow PN (1990. július 1.). „A gene from the human sex-determining region encodes a protein with homology to a conserved DNA-binding motif”. Nature 346 (6281), 240–4. o. DOI:10.1038/346240a0. PMID 1695712.
- Berkovitz GD, Fechner PY, Zacur HW, Rock JA, Snyder HM, Migeon CJ, Perlman EJ (1991. november 1.). „Clinical and pathologic spectrum of 46,XY gonadal dysgenesis: its relevance to the understanding of sex differentiation”. Medicine 70 (6), 375–83. o. DOI:10.1097/00005792-199111000-00003. PMID 1956279.
- Berta P, Hawkins JR, Sinclair AH, Taylor A, Griffiths BL, Goodfellow PN, Fellous M (1990. november 1.). „Genetic evidence equating SRY and the testis-determining factor”. Nature 348 (6300), 448–50. o. DOI:10.1038/348448A0. PMID 2247149.
- Jäger RJ, Anvret M, Hall K, Scherer G (1990. november 1.). „A human XY female with a frame shift mutation in the candidate testis-determining gene SRY”. Nature 348 (6300), 452–4. o. DOI:10.1038/348452a0. PMID 2247151.
- Ellis NA, Goodfellow PJ, Pym B, Smith M, Palmer M, Frischauf AM, Goodfellow PN (1989. január 1.). „The pseudoautosomal boundary in man is defined by an Alu repeat sequence inserted on the Y chromosome”. Nature 337 (6202), 81–4. o. DOI:10.1038/337081a0. PMID 2909893.
- Whitfield LS, Hawkins TL, Goodfellow PN, Sulston J (1995. május 1.). „41 kilobases of analyzed sequence from the pseudoautosomal and sex-determining regions of the short arm of the human Y chromosome”. Genomics 27 (2), 306–11. o. DOI:10.1006/geno.1995.1047. PMID 7557997.
További információk
szerkesztés- GeneReviews/NCBI/NIH/UW entry on 46,XX Testicular Disorder of Sex Development
- OMIM entries on 46,XX Testicular Disorder of Sex Development
- Genes,+sry a U.S. National Library of Medicine Medical Subject Headings (MeSH) honlapján
- Sex-Determining+Region+Y+Protein a U.S. National Library of Medicine Medical Subject Headings (MeSH) honlapján
- PDBe-KB provides an overview of all the structure information available in the PDB for Human Sex-determining region Y protein