Vas(II)-bromid
| vas(II)-bromid | |||
 vas(II)-bromid | |||
| IUPAC-név | vas(II)-bromid | ||
| Kémiai azonosítók | |||
|---|---|---|---|
| CAS-szám | 7789-46-0 | ||
| PubChem | 659170 | ||
| ChemSpider | 74218 | ||
| |||
| |||
| InChIKey | GYCHYNMREWYSKH-UHFFFAOYSA-L | ||
| Kémiai és fizikai tulajdonságok | |||
| Kémiai képlet | FeBr2 | ||
| Moláris tömeg | 215,65 g mol−1 | ||
| Megjelenés | sárgásbarna, szilárd anyag | ||
| Sűrűség | 4,63 g cm−3, szilárd | ||
| Olvadáspont | 684 °C ((anhidrát) 27 °C (hexahidrát)) | ||
| Forráspont | 934 °C | ||
| Oldhatóság (vízben) | 117 g / 100 ml | ||
| Oldhatóság (más oldószerek) | THF, metanol, etanol | ||
| Mágneses szuszceptibilitás | +13,600·10−6 cm³/mol | ||
| Kristályszerkezet | |||
| Kristályszerkezet | romboéderes, hP3 | ||
| Tércsoport | P-3m1, No. 164 | ||
| Koordinációs geometria |
oktaéderes | ||
| Veszélyek | |||
| Főbb veszélyek | nincs | ||
| R mondatok | R20 R36/37/38 | ||
| S mondatok | S26 S36 | ||
| Rokon vegyületek | |||
| Azonos kation | vas(II)-klorid | ||
| Azonos anion | vas(III)-bromid | ||
| Ha másként nem jelöljük, az adatok az anyag standardállapotára (100 kPa) és 25 °C-os hőmérsékletre vonatkoznak. | |||
A vas(II)-bromid szervetlen vegyület, képlete FeBr2. A vízmentes vegyület sárga vagy barnás színű, paramágneses szilárd anyag. Több hidrátformája is ismert, ezek halvány színű szilárd vegyületek. Más vasvegyületek laboratóriumi előállításának szokásos kiindulási anyaga, de ipari alkalmazása nincs.
Szerkezete
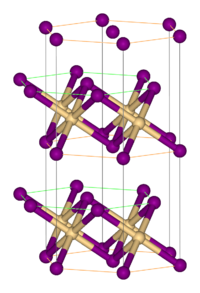
szerkesztésMás fém-halogenidekhez hasonlóan polimer szerkezettel rendelkezik, melyben az izolált fémcentrumokat halogenid kapcsolják össze. CdI2 rácsban kristályosodik, melyben a bromidionok szorosan illeszkedő rétegei közötti oktaéderes lyukakban helyezkednek el a Fe(II) ionok.[1] Ez némileg eltér a FeCl2 rácsától, mely CdCl2 szerkezetű.
Előállítása és reakciói
szerkesztésVaspor és tömény hidrogén-bromid metanolos oldatának reakciójával állítják elő, melynek során [Fe(MeOH)6]Br2 metanol szolvát és hidrogéngáz keletkezik. A metanolkomplexet vákuum alatt melegítve kapjuk a tiszta FeBr2-ot.[2] Vas és elemi bróm reakciójával nem állítható elő, mivel ilyenkor vas(III)-bromid keletkezik.[forrás?]
2 ekvivalens (C2H5)4NBr-rel reagálva [(C2H5)4N]2FeBr4 keletkezik belőle.[3]
Bromiddal és brómmal reagáltatva intenzív színű [FeBr3Br9]−-et képez.[4]
Mint minden vas(II) vegyület, a FeBr2 is gyenge redukálószer.[forrás?]
Mágnesessége
szerkesztés4,2 K-en erősen metamágneses, a metamágneses vegyületek prototípusaként sokat tanulmányozták.[5][6]
Hivatkozások
szerkesztés- ↑ Haberecht, J.; Borrmann, H.; Kniep, R. "Refinement of the Crystal Structure of Iron Dibromide, FeBr2" Zeitschrift für Kristallographie - New Crystal Structures 2001, vol. 216, p. 510. doi:10.1524/ncrs.2001.216.14.544
- ↑ G. Winter, "Iron(II) Halides" "Inorganic Syntheses" 1973, volume 14, pages 101-104. doi:10.1002/9780470132456.ch20
- ↑ N. S. Gill, F.. B. Taylor Inorganic Syntheses 1967, volume 9, page 136-142. doi:10.1002/9780470132401.ch37
- ↑ Holleman, A. F.; Wiberg, E. "Inorganic Chemistry" Academic Press: San Diego, 2001. ISBN 0-12-352651-5
- ↑ (1959. január 15.) „Neutron Diffraction Investigations of the Magnetic Ordering in FeBr2, CoBr2, FeCl2, and CoCl2”. Physical Review 113 (2), 497–507. o. DOI:10.1103/PhysRev.113.497.
- ↑ (1967. december 10.) „Metamagnetic Phase Transitions and Hysteresis in FeCl2”. Physical Review 164 (2), 866–878. o. DOI:10.1103/PhysRev.164.866.
Fordítás
szerkesztésEz a szócikk részben vagy egészben az Iron(II) bromide című angol Wikipédia-szócikk ezen változatának fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.