Hírvivő RNS
A hírvivő RNS vagy angolos rövidítéssel mRNS (messenger RNA) egyszálú ribonukleinsav, amely az örökletes genetikai információt közvetíti a sejtek információit tároló DNS molekulából a fehérjeszintézis helyszínére, a riboszómákhoz. Miután az mRNS átíródott a DNS-ről, az eukarióta sejtekben jelentős módosulásokon megy keresztül (baktériumokban ez a fázis elmarad), majd a citoplazmába kerül, ahol a riboszómákhoz kapcsolódva az adenin, citozin, guanin, uracil nukleobázisok szekvenciája alapján elkészülnek az új proteinek.

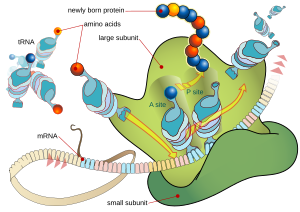
Az mRNS néhány száz vagy néhány ezer nukleotid alapegységekből álló lineáris polimer molekula. Az mRNS-ről lefordításra kerülő tripleteket Sydney Brenner nevezte el az ötvenes évek végén kodonoknak. Az mRNS szerkezetének kódoló részén három triplet nukleotid határoz meg (a genetikai kódszótárban 5’→3’ irányban felírt RNS kodonok vannak aminosavakhoz rendelve[1]) egy aminosavat a fehérjékben, a genetikai kódnak megfelelően.
Az 1950-es évek végére a molekuláris biológia előtt nem volt még válasz arra a kérdésre, hogy a DNS-ből származó információk hogyan alakulnak át fehérjékké. Az mRNS létét először a Nobel-díjas Jacques Monod és François Jacob feltételezte, majd ennek alapján Jacob, Sydney Brenner és Matthew Meselson fedezte fel a molekulát 1961-ben.[2] 2020-ban az mRNS-kutatások eredményei nyitottak utat a világjárványt okozó SARS-CoV-2 vírus fertőzés legyőzéséhez.[3] Az emberi sejtekben lévő messenger RNS (mRNS) módosított változatának megtervezése, majd a célba juttatására szolgáló rendszer kifejlesztése révén Karikó Katalin és Drew Weissman kutatómunkája alapozta meg a Pfizer/BioNTech és a Moderna gyógyszergyártók által kifejlesztett védőoltások technológiáját.[4]
Felépítése
szerkesztésA DNS- és RNS-molekulához hasonlóan a hírvivő RNS is nukleotidokból épül fel. A nukleotidok foszforsavat, öt szénatomos cukrot (pentóz), és nitrogén tartalmú szerves bázist tartalmaznak. Az RNS-ek pentózként ribózt, szerves bázisként pedig adenint, guanint, citozint, valamint a DNS-molekuláktól eltérően timin helyett uracilt tartalmaznak. Minden RNS-molekula egyetlen polinukleotid-szálból épül fel, amely változatos másodlagos térszerkezetet vehet fel.
Az mRNS életciklusa
szerkesztésAz mRNS-molekula a transzkripcióval kezdi létét, melynek során a DNS egyik száláról az RNS-polimeráz enzim, annak szekvenciája alapján RNS-másolatot készít. Bakteriális sejtekben ez a másolat máris képes ellátni a funkcióját és gyakran már akkor rákapcsolódnak a riboszómák, mielőtt a transzkripció teljesen véget érne. Eukarióta sejtekben azonban az RNS-polimeráz egy enzimkomplexum része, amely ezt a prekurzor mRNS-t (pre-mRNS-t) modifikálja, "érett mRNS-sé" alakítja át.
Poszttranszkripciós módosítások
szerkesztés5' cap: az érett mRNS (leolvasási szempontból) elején, az 5' végén elhelyezkedő első nukleotidhoz egy 7-metilguanozin molekula kapcsolódik 5'-5' trifoszfátkötéssel. Ez az úgynevezett "sapka" (angolul cap), amelynek megléte alapvető fontosságú ahhoz, hogy a riboszóma felismerje az mRNS-t, a sejt ribonukleázai (RNáz) viszont ne bontsák le. Prokarióta sejtek, illetve mitokondriumok és kloroplasztiszok mRNS-ein nincs sapka.
Az 5' cap nem sokkal a transzkripció megkezdése után, még az átírás befejezése előtt kapcsolódik az mRNS első nukleotidjához a transzkripciós komplex egyik enzime révén.
Splicing: Az eukarióta gének több nem-kódoló szakaszt, úgynevezett intront tartalmaznak. Ezek a transzkripció során átíródnak az mRNS-be, de aztán a splicing (szplájszing) folyamata révén kivágódnak belőle és a riboszómákig már csak a kódoló szekvencia jut el. Egyes gének esetében az enzimek a kódoló szakaszok egy részét is kivágják, és ennek szabályozásával egy génről eltérő fehérjék készíthetők (alternatív splicing). A splicingot többnyire egy enzimkomplexum végzi, de egyes RNS-molekulák maguk is rendelkeznek enzimaktivitással (ribozimek) és képesek maguk elvégezni a splicingot.
Ritka esetekben a kódoló szakaszt is megváltoztatják. Az ember esetében az apolipoprotein B mRNS-t bizonyos szövetekben módosítják, korai stopkodont hoznak létre benne, amely megállítja a transzlációt, és rövidebb fehérjék jönnek létre.
Poliadeniláció: az érett mRNS 3'-végén egy hosszú, akár sok száz adenilcsoportból álló poli(A) farok található (vagyis szekvenciája AAAAA...). Újabban felfedezték, hogy rövid uridilszakaszok is betölthetik a szerepét.[5] A poli(A) farok megvédi az mRNS-t a lebontó nukleázoktól, segíti a transzportját és a transzlációt. Prokarióta mRNS is lehet poliadenilálva, de ott a "farok" nemhogy védene a nukleázoktól, hanem elősegíti a lebontást.
A poliadenilációra közvetlenül az átírás után (vagy akár közben) kerül sor. Az RNS-polimeráz emzimkomplexumának egyik tagja levágja a molekula végét és a poliadenilát-polimeráz enzim kb. 250 adenilcsoportot kapcsol a 3'-véghez. Akárcsak a splicing esetében, a poliadenilációnak is több alternatív variációja lehetséges.
Transzport
szerkesztésA prokarióták esetében nincs szükség transzportra, mert a DNS és a riboszómák nincsenek térben elválasztva egymástól. Az eukarióták esetében, azonban a sejtmagban elhelyezkedő kromoszómáktól ki kell szállítani az mRNS-t a citoplazmába.[6] Az érett mRNS 5' cap-jét a CBP20 és CBP80 proteinek[7] és a transzkripciós/export komplex (TREX)[8][9] ismeri fel, és áttranszportálják a maghártya pórusain. A transzportnak több útvonala is lehetséges.[10] Az idegsejtek esetében a sejttestben elhelyezkedő magból a dendritek riboszómáiig az mRNS-nek jelentős távolságot kell megtennie.
Transzláció
szerkesztésBaktériumok esetében a transzláció azonnal megkezdődik az átírás után, sőt esetenként már közben is (ún. transzkripcióhoz kapcsolt transzláció).
Az eukarióta mRNS-t a citoplazmában szabadon úszó vagy az endoplazmatikus retikulumhoz kötött riboszómák kötik meg (utóbbi esetben a szignálfelismerő részecskék vezetik oda). A kapcsolódás után a riboszómák az mRNS szekvenciája alapján a transzfer RNS-ek által szállított aminosavakból megszintetizálják a fehérjét.[11]
Az eukarióta mRNS-ek többnyire monocisztronikusak (a cisztron az a génszakasz, amelyről egy fehérje íródik át), vagyis egy protein készül róluk.[12][13] A baktériumok (beleértve a mitokondriumokat is[14]) hírvivő RNS-ei azonban gyakran több nyitott leolvasási keretet (open reading frame, ORF) tartalmaznak és több polipeptidlánc készülhet róluk. Ezek a fehérjék általában hasonló funkciójúak és együttesen operonokat alkotnak.
Szerkezete
szerkesztésAz mRNS bázissorrendjének lefordítása a riboszómán történik. Az első kodonokat Marshal Nirenberg határozta meg 1961-ben.[15] A sejtplazmában minden tRNS bázishármasával kapcsolódó része az antikodon, amely a komplementaritás alapján felismeri az mRNS molekulában a kodont. Az olvasás mindig a lánckezdő metionintól (AUG) kezdődik, és a stop jelig tart, amelyhez nem kapcsolódik aminosav.
Kódoló szakasz
A kódoló szakasz szekvenciája fehérjékké íródik át a genetikai kódnak megfelelően. Ez a régió egy startkodonnal kezdődik és stopkodonnal ér véget. A startkodon általában az AUG hármas, amely eukariótákban metionint kódol, míg prokariótákban a startkodon az N-formilmetionint (módosult aminosavat) jelenti. A stopkodon az UAA, UAG vagy UGA. A kódoló szakasz esetenként másodlagos RNS-szerkezetet vehet fel, amely megvédi a lebontó enzimektől,[16][17] vagy olyan szekvenciák lehetnek benne, amelyek elősegítik vagy gátolják az intronok splicingját.
Átíratlan régiók
Az érett mRNS-ben a kódoló szakasz előtt és után fehérjévé át nem írt régiók találhatók, angol rövidítéssel ezeket UTR-nek hívják (untranslated region), elhelyezkedésüknek megfelelően 5'UTR-nek vagy 3'UTR-nek. Ezeknek a szekvenciáknak különböző funkciókat tulajdonítanak, szerepük lehet az mRNS stabilitásában, transzportjában és a transzláció hatékonyságában egyaránt.
Az UTR-ek védhetik az mRNS-t a lebontás ellen (vagy ellenkezőleg, elősegíthetik azt) aszerint, hogy csökkentik vagy növelik kapcsolódási képességét a lebontó ribonukleázokhoz vagy a lebontást segítő másodlagos proteinekhez. Egyes fehérjék kapcsolódhatnak az UTR-ekhez, amelyek befolyásolják a riboszómák mRNS-kötő képességét, sőt esetenként teljesen megakadályozhatják a transzlációt. A 3'UTR-hez mikroRNS-ek is kötődhetnek, ahol a fehérjékhez hasonló hatást fejthetnek ki.
Feltételezik, hogy az mRNS szállítási helye a citoplazmában is a 3'UTR-ben van kódolva.
Egyes esetekben az UTR-ek RNS-e olyan másodlagos struktúrát vehet fel, amely saját maga képes kisebb molekulákat megkötni és változtatni a transzláció hatékonyságát (ún. ribokapcsolók, riboswitch-ek). Ilyenkor az RNS saját magát szabályozza.
Lebomlás
szerkesztésA különböző génekről készült mRNS-ek élettartama nagyon változó lehet, baktériumokban néhány másodperctől több mint egy óráig, emlősökben pár perctől akár napokig is megmaradhatnak.[18] Minél stabilabb egy mRNS, annál több fehérje készül róla. Az RNS stabilitását regulálva a sejt befolyásolhatja a proteinszintézis mértékét és alkalmazkodni tud a környezet gyors változásaihoz.
Prokarióták
szerkesztésA bakteriális mRNS élettartama általában jóval rövidebb, mint az eukariótáké. Az RNS-t lebontóenzimek kombinációjával tüntetik el, amelyek közé endonukleázok (az RNS-lánc belsejében hasítanak) és 5' vagy 3' exonukleázok (amelyek a lánc valamelyik végéről kezdik a bontást) tartoznak. Egyes esetekben kis (pár tíz vagy száz bázis hosszú) egyszálú RNS-ek kapcsolódnak a lebontásra ítélt mRNS-hez, hogy a kétszálú RNS-re specializálódott RNáz III is szerephez jusson.
Eukarióták
szerkesztésAz eukarióták esetében az 5'caphoz kapcsolódó transzlációs iniciációs faktorok (eIF-4E és eIF-4G) és a poli(A) farok-kötő protein védi az mRNS-t a bontóenzimektől. Az RNS-bontást az ún. P-testek (processzáló testek) és az exoszómák végzik.[19] A feleslegessé vált mRNS-eken erre specializálódott exonukleázok rövidítik meg a poli(A) farkat.
Az RNS-interferencia folyamata is az mRNS-ek lebontásával szabályozza a génexpressziót. A feltevések szerint főleg vírusellenes sejten belüli védekezési mechanizmus során kis, 20-25 nukleotidból álló RNS-szakaszok kapcsolódnak a hírvivő RNS-hez és a kettős szálú RNS-ekre specializálódott RNázok pedig lebontják őket.[20]
Alkalmazása
szerkesztésA hírvivő RNS felhasználható bármely fertőzés szimulációjaként. Amikor egy oltóanyag célja, hogy kiváltsa az immunrendszer reakcióját egy kórokozó ellen anélkül, hogy az betegséget okozna. Az mRNS-t a sejtbe juttatva olyan fehérjék termelésére késztetik a szervezetet, amelyek betegségek vagy fertőzések gyógyítására alkalmasak. 2020-ban a COVID-19 járvány ellen dolgoztak ki olyan RNS-alapú vakcinákat, amelyek elkészítéséhez többek között Karikó Katalin mRNS-terápiás szabadalma is hozzájárult. A kifejlesztett vakcina alapvetően biotechnológiai módszerrel módosított hírvivő RNS molekulákat tartalmaz, az immunrendszert serkentő vírusfehérje egy lipid nanorészecskébe zárva jut a szervezetbe. Az mRNS alapú védőoltás beadása után, az mRNS molekulák a véráramon keresztül a vérsejtek citoplazmájába kerülnek, ezután a fertőző vírus elleni sikeres védekezéshez szükséges fehérje előállítását már az immunrendszer végzi el.[21][22][23]
Jegyzetek
szerkesztés- ↑ A biokémia és molekuláris biológia alapjai Nyitray László, Pál Gábor (2013). (Hozzáférés: 2021. január 2.)[halott link]
- ↑ 1960 The discovery of messenger RNA (mRNA) by Sydney Brenner (1927-), Francis Crick (1916-), Francois Jacob (1920-) and Jacques Monod (1910-1976).. (Hozzáférés: 2021. január 2.)
- ↑ Covid vaccine technology pioneer: 'I never doubted it would work'. (Hozzáférés: 2021. január 9.)
- ↑ Rosenstiel Award given to pioneering scientists behind COVID-19 vaccines. (Hozzáférés: 2021. január 22.)
- ↑ Choi et al. RNA. 2012. 18: 394-401
- ↑ Quaresma, Alexandre J.; Sievert, Jeffrey A. & Nickerson, J. A. (2013), "Regulation of mRNA export by the PI3 kinase/AKT signal transduction pathway", Mol Biol Cell 8 (8): 1208–21, DOI 10.1091/mbc.E12-06-0450
- ↑ (2009. szeptember 1.) „The Arabidopsis CBP20 targets the cap-binding complex to the nucleus, and is stabilized by CBP80”. The Plant Journal 59 (5), 814–825. o. [2015. október 5-i dátummal az eredetiből archiválva]. DOI:10.1111/j.1365-313X.2009.03915.x. (Hozzáférés: 2014. december 12.)
- ↑ (2002. április 28.) „TREX is a conserved complex coupling transcription with messenger RNA export”. Nature 417 (6886), 304–308. o. DOI:10.1038/nature746. PMID 11979277. (Hozzáférés: 2014. december 12.)
- ↑ (2014. október 27.) „Roles of the TREX complex in nuclear export of mRNA”. RNA Biology 6 (2), 149–152. o. DOI:10.4161/rna.6.2.8046. (Hozzáférés: 2014. december 12.)
- ↑ (2011) „Genome Analysis Reveals Interplay between 5′UTR Introns and Nuclear mRNA Export for Secretory and Mitochondrial Genes”. PLoS Genetics 7 (4), e1001366. o. DOI:10.1371/journal.pgen.1001366. ISSN 1553-7404. PMID 21533221. PMC 3077370.
- ↑ somalia
- ↑ Kozak, M. (March 1983), "Comparison of initiation of protein synthesis in procaryotes, eucaryotes, and organelles", Microbiological Reviews 47 (1): 1–45
- ↑ Niehrs C, Pollet N (December 1999), "Synexpression groups in eukaryotes", Nature 402 (6761): 483–7, DOI 10.1038/990025
- ↑ (2011) „The Human Mitochondrial Transcriptome”. Cell 146 (4), 645–658. o. DOI:10.1016/j.cell.2011.06.051. ISSN 00928674.
- ↑ Genetics and Genomics Timeline 1961 Marshall Nirenberg (1927-) cracks the genetic code. (Hozzáférés: 2021. január 2.)
- ↑ Shabalina SA, Ogurtsov AY, Spiridonov NA (2006), "A periodic pattern of mRNA secondary structure created by the genetic code", Nucleic Acids Res. 34 (8): 2428–37, DOI 10.1093/nar/gkl287
- ↑ Katz L, Burge CB (September 2003), "Widespread Selection for Local RNA Secondary Structure in Coding Regions of Bacterial Genes", Genome Res. 13 (9): 2042–51, DOI 10.1101/gr.1257503
- ↑ Structural and Functional Analysis of an mRNP Complex That Mediates the High Stability of Human β-Globin mRNA. National Center for Biotechnology Information . (Hozzáférés: 2014. június 4.)
- ↑ Parker, R. & Sheth, U. (2007), "P Bodies and the Control of mRNA Translation and Degradation", Molecular Cell 25 (5): 635–646, doi:10.1016/j.molcel.2007.02.011, <http://linkinghub.elsevier.com/retrieve/pii/S1097276507001116>
- ↑ Obbard, D.J.; Gordon, K.H.J. & Buck, A.H. et al. (2009), "The evolution of RNAi as a defence against viruses and transposable elements", Philosophical Transactions of the Royal Society B: Biological Sciences 364 (1513): 99–115, DOI 10.1098/rstb.2008.0168
- ↑ Hányatatott sorsú magyar szabadalom is kellett a most bejelentett vakcinához. Forbes, 2020. november 9. [2021. január 26-i dátummal az eredetiből archiválva]. (Hozzáférés: 2020. november 17.)
- ↑ A koronavírus elleni legígéretesebb vakcinafejlesztés megalapozója Karikó Katalin, az SZTE alumnusa. (Hozzáférés: 2020. november 15.)
- ↑ AZ MRNS-SZTORI. (Hozzáférés: 2020. december 19.)
Fordítás
szerkesztés- Ez a szócikk részben vagy egészben a Messenger RNA című angol Wikipédia-szócikk ezen változatának fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.